
Wenn wir das Leben betrachten – von den tiefen Wäldern bis zu schneebedeckten Gipfeln, von schimmernden Korallenriffen bis zu den mächtigen Blauwalen, von winzigen Mikroben bis zu schwirrenden Insekten, sehen wir eine Geschichte, die sich über Milliarden Jahre entfaltet. Diese Geschichte wird oft als „Baum des Lebens“ beschrieben: ein Geflecht aus Ästen, das alle Arten miteinander verbindet und zu einem gemeinsamen Ursprung zurückführt.
Doch je tiefer wir in diesen Baum blicken, desto verschwommener werden seine Wurzeln. Sie verlieren sich im Nebel der Zeit – und dort, ganz am Anfang von allem, flüstert eine andere, eine verborgene rätselhafte Geschichte.
Es begann im Halbdunkel. In den warmen Adern der Erde, wo brodelnde Quellen Elemente umspülten und das grüne Meer noch ein Alphabet aus Ionen war. Zwischen Schwefelwolken und schwarzem Basalt falteten sich die ersten Worte aus Molekülen, zunächst zerbrechlich, verhakt im thermischen Atem der Tiefe. Nicht Leben, nicht Tod – nur eine Ahnung. Moleküle, die Informationen trugen und chemische Reaktionen antrieben. Manchmal zerfielen sie. Manchmal tasteten sie sich gegenseitig ab. Und manchmal, ganz leise, flüsterten sie weiter.
War dieses Flüstern Zufall? Oder schon ein Plan?
Wer sich aufmacht, den Ursprung des Lebens zu ergründen, betritt kein gut ausgeleuchtetes Museum – sondern ein Labyrinth. Es gibt kein klares „so war es“, sondern ein Netz aus Hypothesen, Wahrscheinlichkeiten, Mechanismen und Lücken. Was wir heute über die Anfänge des Lebens wissen, ist das Ergebnis intensiver Forschung, verblüffender Funde – und immer auch: offener Fragen.
In diesem Labyrinth führen viele Pfade ins Unbekannte. Eine der faszinierendsten Spuren ist die RNA-Welt-Hypothese: eine Erzählung, in der winzige Moleküle – RNA – die ersten Töne des Lebens sangen. Doch andere Geschichten flüstern mit: von Mineralien, die Moleküle zusammenhielten, von winzigen Eiweißketten, die Stabilität schufen, von fettartigen Hüllen, die Schutz boten. Vielleicht waren all die Pfade ineinander verschlungen – und führten doch gemeinsam zur RNA, die eine Brücke zwischen Chemie und Leben schlug. Dorthin, wo das erste Flüstern hörbar wurde.
Dieser Text folgt der Spur durch den Nebel:
der Ahnung, dass RNA einst der Anfang von allem war.
1. Akt: Vom Chaos zur RNA-Welt – Die Bausteine erwachen
Szene 1: Ursuppe – die Geburt einfacher Moleküle
Szene 2: Basen – Buchstaben aus Stickstoff und Kohlenstoff
Szene 3: Zucker: Ribose – süß und fragil
Szene 4: Phosphat – der universelle Kleber
Szene 5: Sternenstaub & Einschläge – ein kosmischer Beitrag?
2. Akt: Labore der Natur – Geburtsstätten der RNA
Szene 1: Die Schmiede der Tiefe – Hydrothermale Quellen
Szene 2: Die Alchimie des Tons – Geburtsstätten an Land
Szene 3: Viele Wege, ein Ziel
3. Akt: Die ersten Selbstreplikatoren erwachen
Szene 1: Von der Kette zum Werkzeug – RNAs funktionelle Reifung
Szene 2: Die Kraft der Faltung
Szene 3: Der energetische Pakt
Szene 4: Partielle Replikation
Szene 5: Trennung – ein Abschied, der Neues schuf
Szene 6: Von kleinen zu längeren Ketten: Die Macht der Ribozyme
Szene 7: Fehler als Chance: Der Motor der Evolution
4. Akt: Leben im Tropfen – Lipidvesikel als Schutzräume
Szene 1: Die ersten Festungen
Szene 2: Der Eintritt – Verschleppung oder Einwanderung?
Szene 3: Der Pakt – RNA stabilisiert, Vesikel schützen
Szene 4: Die Chance der Unvollkommenheit
Szene 5: Selektion im Tropfen
5. Akt: Vom Zufall zur Funktion – wie RNA an Komplexität gewann
Szene 1: Eine zufällige RNA entsteht
Szene 2: Vom RNA-Strang zum Ribozym
Szene 3: Die RNA kopiert sich – mit Fehlern
Szene 4: Die Mutation schafft eine neue Funktion
Szene 5: Selektion begünstigt nützliche RNAs
Szene 6: Die RNA zwischen Fehler und Funktion
Epilog: Das Echo der Ursuppe

1. Akt: Vom Chaos zur RNA-Welt – Die Bausteine erwachen
Heute ist das Leben ein wohlorganisiertes Gefüge: Die DNA archiviert Wissen, die RNA überbringt Botschaften, Proteine verrichten die Arbeit. Doch am Anfang gab es keine Struktur – nur ein einziges Molekül – das alles konnte: RNA. Sie könnte der erste Akteur gewesen sein – gleichzeitig Archiv, Bote und Werkzeug.
Genau das schlägt die RNA-Welt-Hypothese vor: RNA als erster „Lebensbaustein“, fähig – wie DNA Informationen zu speichern und wie Enzyme chemische Reaktionen zu katalysieren – und das ganz ohne Hilfe.
RNA besteht aus wiederkehrenden Bausteinen – den Nukleotiden.
Jedes Nukleotid setzt sich aus drei Teilen zusammen:
🧩 einer Nukleobase (wie Adenin, Uracil, Guanin oder Cytosin),
⬟ einem Zucker (Ribose) und
⚡einer Phosphatgruppe, die wie eine Klammer wirkt – und daraus eine Kette entstehen lässt.
Doch wie entstand dieses Wundermolekül in einer toten Welt?
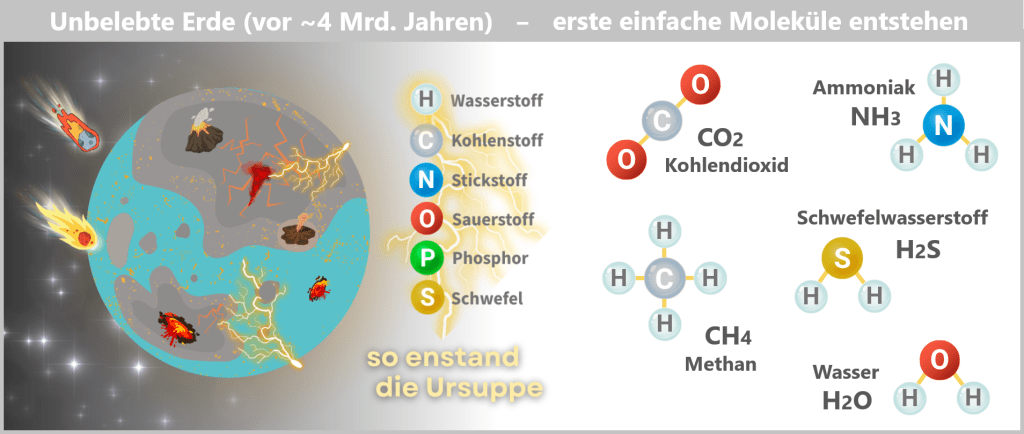
Szene 1: Ursuppe – die Geburt einfacher Moleküle
Vor rund vier Milliarden Jahren waren die schlimmsten Geburtswehen der jungen Erde überstanden – doch der Planet blieb ein feuriges, unruhiges Chaos. Vulkane spuckten giftige Gase und brodelnde Lava, Meteoriten schlugen Krater wie Wunden und ließen die jungen Ozeane kochen.
Hier, in dieser glutgetränkten Wildnis, mischten sich sechs Elemente zu einem Ur-Cocktail:
- Wasserstoff – flüchtig wie Geisterhauch
- Kohlenstoff – der geschmeidige Verbinder
- Stickstoff – starrköpfig, aber unverzichtbar
- Sauerstoff – feurig und reaktionsfreudig
- Phosphor – der energiereiche Funken
- Schwefel – stinkend, aber ungemein nützlich.
Diese Grundelemente waren allgegenwärtig – tief im Gestein der Erde, gelöst in den heißen Meeren oder freigesetzt durch vulkanische Glut. Sie warteten nur auf Energie. Blitze zuckten durch die Dunstglocke, UV-Licht brannte auf die Gezeitenzonen, und in der Tiefe buk Magma die Ozeane zu chemischen Kesseln. Allmählich verbanden sich die Elemente zu Gasen wie Methan (CH₄), Kohlendioxid (CO₂) und Ammoniak (NH₃) – einfache Moleküle, doch reich an chemischem Potenzial.
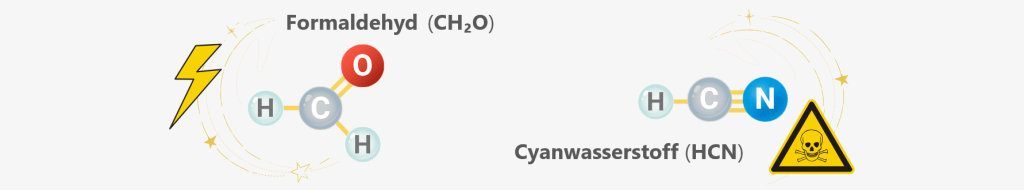
Und sie reagierten weiter. In heißen Ozeanen, auf trocknenden Schlammflächen oder in mineralreichen Quellen formten diese Gase organische Moleküle wie Cyanwasserstoff (HCN) und Formaldehyd (CH₂O) – todbringende Substanzen, paradoxerweise das Rohmaterial, das Leben erst möglich machte.
Konnten sich in dieser Höllenlandschaft tatsächlich die Bausteine des Lebens formen?
1953 gaben zwei Forscher die Antwort – in einem Glasgefäß, kaum größer als eine Teekanne. Stanley Miller und Harold Urey mischten Methan, Ammoniak, Wasserstoff und Wasserdampf – und ließen Blitze hindurchzucken.
Nach einer Woche war die Flüssigkeit – die „Ursuppe“ – trüb von Aminosäuren: jenen organischen Verbindungen, aus denen später Proteine (die „Molekularen Maschinen der Zellen“) entstehen sollten. Noch kein Leben, aber der Beweis: Aus Chaos kann Ordnung entstehen.
Und dann der Fund, der kaum beachtet wurde: Cyanwasserstoff (HCN) und Formaldehyd (CH₂O) – zwei Substanzen, ohne die RNA nie entstanden wäre.
Heute weiß man: Die verwendeten Gase entsprachen wahrscheinlich nicht exakt den Bedingungen der frühen Erde. Methan und Ammoniak waren wohl seltener als gedacht, die Atmosphäre eher neutral – reich an CO₂ und Stickstoff. Doch das Prinzip bleibt gültig: Selbst unter einfachen Bedingungen entstehen Bausteine des Lebens. Moderne Experimente zeigen (Cleaves et al., 2008; Bonfio et al., 2018), dass selbst unter CO₂-reichen Bedingungen – wie sie die frühe Erde wohl prägten – Lebensbausteine entstehen. Mit mineralischer Hilfe (Erastova et al., 2017) wird die Synthese sogar effizienter.
Das Spannende daran: Es scheint nicht den einen Weg zu geben, der ins Leben führt – sondern viele. Unterschiedliche Umgebungen, verschiedene Reaktionswege, andere Zutaten – und doch entstehen immer wieder dieselben fundamentalen Bausteine.
Auch wenn die frühe Erdatmosphäre wahrscheinlich nicht so reich an Methan und Ammoniak war, wie Miller und Urey einst annahmen – Cyanwasserstoff (HCN) und Formaldehyd (CH₂O) könnten dennoch entstanden sein. Lokale chemische Nischen, Blitze, UV-Licht oder sogar Meteoriten lieferten immer wieder Energie – genug, um diese reaktiven Moleküle hervorzubringen.
Wie aber wird aus Gas und Energie ein Code?
Das eigentliche Wunder folgte erst noch:
Szene 2: Basen – Buchstaben aus Stickstoff und Kohlenstoff
Cyanwasserstoff (HCN) und Formaldehyd (CH₂O) waren in der Ursuppe reichlich vorhanden. In den Schmieden der Tiefe – beheizt von Vulkanen, geknetet von Mineralien – verbanden sie sich zu Purin– und Pyrimidinringen – organische Gerüste aus Kohlenstoff- und Stickstoffatomen.
Aus diesen Ringen entstanden schließlich stabile Strukturen – chemische Buchstaben mit erstaunlicher Beständigkeit. Adenin war nur eines davon.

Cyanwasserstoff-Moleküle (HCN) trafen in einer Lagune auf Formaldehyd (CH₂O). Sie reagierten – nicht aus Absicht, sondern weil die Chemie es verlangte. Stickstoffatome verhakten sich, Kohlenstoffringe schlossen sich. Irgendwann war es da: Adenin, die Purinbase, die später einmal den Code für ganze Ökosysteme tragen würde.
Aus Purin- und Pyrimidin-Ringen wuchs ein ganzes Alphabet des Lebens: Adenin und Guanin aus den Purinen, Cytosin, Uracil und Thymin aus den Pyrimidinen.
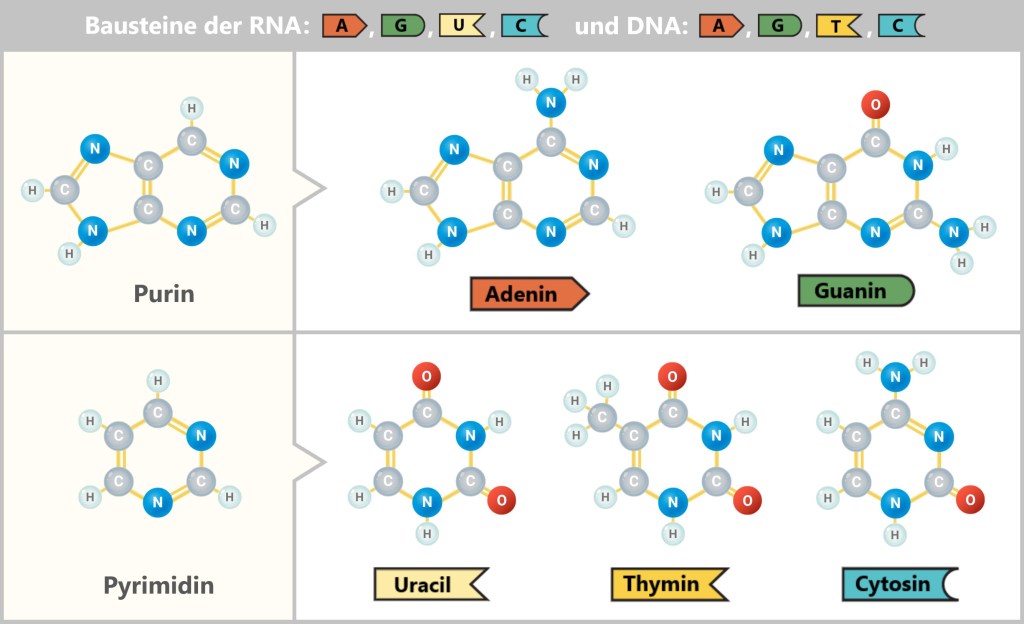
Noch waren sie stumm, noch trugen sie keine Botschaft. Doch in ihren Ringen schlummerte eine seltsame Fähigkeit – als könnten sie Geheimnisse bewahren, die sie selbst nicht verstanden.
Heute wissen wir: Diese Reaktionen sind Teil eines chemischen Pfades (Patel et al., 2015), der realistisch zur Entstehung von Purinen und Pyrimidinen führen kann – den „Buchstaben“ der RNA.
Doch ein Alphabet ist noch kein Wort. Was fehlte, war ein Rhythmus, ein Rückgrat – eine Struktur, an der sich die Buchstaben festhalten konnten: Ribose, der süße Träger der Bedeutung.
Szene 3: Zucker: Ribose – süß und fragil
Während sich die Basen in brodelnden Tümpeln formten, wob die Erde an anderer Stelle ihren zarten Partner: Ribose, einen Zucker aus fünf Kohlenstoffatomen – aufgereiht wie Perlen auf einer Kette.
Ribose war ein Wesen von zerbrechlicher Schönheit:
- süß in ihrer chemischen Seele wie alle Zucker und
- fragil, denn in Wasser zerfiel sie leicht.
Um diese Kostbarkeit zu bewahren, streckte die Erde ihre Arme aus: Borat-Minerale aus vulkanischen Tiefen schlossen die Ribose schützend ein – nicht zu fest, und nur so lange, wie nötig. Bis der richtige Moment kam, um wieder loszulassen.
Was passiert sein könnte?
In vulkanischen Regionen – besonders in austrocknenden Tümpeln oder mineralreichen Gewässern – trafen drei entscheidende Zutaten aufeinander:
- Formaldehyd (CH₂O), ein einfacher organischer Baustein,
- Energie wie UV-Licht oder vulkanische Hitze und
- Borat-Minerale, entstanden durch Gesteinsverwitterung.
Diese Mischung setzte eine chemische Kettenreaktion in Gang: die Formose-Reaktion. Dabei verbanden sich mehrere Moleküle Formaldehyd zu verschiedenen Zuckern – einer davon war Ribose.

Doch sie war nur eine unter vielen – und besonders instabil. Ihre zahlreichen –OH-Gruppen machten sie hochreaktiv und anfällig für Zerfall in wässriger Umgebung.
Die Rettung kam aus dem Gestein: In den Tümpeln mit Borat-Mineralen lösten sich Borat-Ionen (B(OH)₄⁻) im Wasser und verbanden sich bevorzugt mit Ribose. Diese Bindung an zwei benachbarten –OH-Gruppen blockierte die empfindlichsten Reaktionsstellen und stabilisierte das Molekül – nicht dauerhaft, aber lange genug. Ribose überlebte nun nicht nur Minuten, sondern Tage.

Links: Freie Ribose – ein Zucker mit mehreren Hydroxylgruppen (–OH), die anfällig für Zerfall sind.
Mitte: Borat-Ion (B(OH)₄⁻) – kommt z. B. in Borax-Mineralen vor.
Rechts: Ribose-Borat-Komplex – das Borat-Ion bindet an zwei benachbarte OH-Gruppen der Ribose. Dadurch wird die instabile Zuckerstruktur „eingefroren“ und vor dem Zerfall geschützt.
Überraschenderweise: Ausgerechnet Borat, ein unscheinbares Nebenprodukt vulkanischer Prozesse, wurde zum Hüter eines Schlüsselmoleküls des Lebens.

Laborexperimente beweisen: Ribose kann in vulkanischen Tümpeln entstehen – doch nur Borat verwandelte dieses chemische Lotteriespiel in einen überlebensfähigen Plan.
Albert Eschenmoser (ETH Zürich) zeigte, dass Formaldehyd in alkalischer Lösung (pH 10–12, simuliert vulkanische Tümpel) unter Hitze zu Zuckern wie Ribose polymerisiert – allerdings chaotisch, mit <1% Ribose-Anteil (Eschenmoser, 2007).
Steve Benner (Foundation for Applied Molecular Evolution) wies nach, dass Borat-Ionen den Zucker Ribose in wässriger Lösung stabilisieren – sie binden sich dabei gezielt an bestimmte Bereiche der Ribose, sogenannte cis-Diol-Gruppen (zwei benachbarte OH-Gruppen), und schützen sie so vor dem Zerfall (Ricardo et al., 2004).
Desoxyribose – Der stille Zwilling
Neben Ribose entstand im Stillen eine zweite Gestalt: Desoxyribose, ihr leiser Zwilling. Geboren im selben Tanz der Moleküle, vermutlich beschützt von Borat, vielleicht geformt von Ton. Nur ein winziges Detail unterschied sie von ihrer Schwester: ein Sauerstoffatom fehlte – daher ihr Name: „Desoxy“ – ohne Sauerstoff.
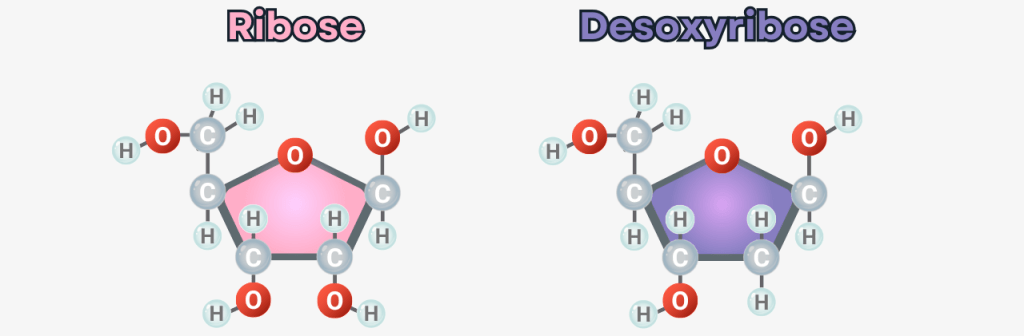
Eine scheinbare Kleinigkeit mit gewaltiger Wirkung. Die fehlende –OH-Gruppe machte Desoxyribose weniger reaktiv, aber deutlich stabiler. Noch stand sie im Schatten – unscheinbar, unbemerkt.
Während Ribose das Rückgrat der RNA bildet (RNA = Ribonukleinsäure), trägt Desoxyribose die Struktur der DNA (DNA = Desoxyribonukleinsäure). Die Natur hatte vorgesorgt: Ribose für den Moment. Desoxyribose für die Ewigkeit.
Doch bevor die Geschichte weitergehen konnte, fehlte noch ein entscheidendes Element: ein molekularer Klebstoff, der die Buchstaben mit den Zuckern zu Silben verbinden konnte. Die Natur brauchte einen universellen Verbündeten – sie brauchte Phosphat.
Szene 4: Phosphat – der universelle Kleber
Während Ribose und Basen in den warmen Tümpeln der jungen Erde dahindämmerten, fehlte noch der Dritte im Bunde – ein Molekül, das mehr konnte als nur existieren. Ein Verbinder.
Phosphat war ein Kind des Feuers und des Wassers: geboren in Apatit-Gesteinen tief im Inneren der Erde, wo Hitze und Druck die Elemente schmolzen. Dort blieb es gefangen, bis die Oberfläche zu brodeln begann.
Vulkane spien ihre feurigen Gase – Kohlendioxid, Schwefeldioxid – diese vermischten sich mit Wasser zu säurehaltigen Nebeln, die selbst das härteste Gestein zermürbten. Verdunstung und Kondensation spülte das Phosphat aus dem Stein, hinein in die flachen Tümpel, wo bereits Zucker und Basen schwebten. Dort wartete es – scheinbar unscheinbar: ein Ion mit drei negativen Ladungen, unruhig und bindungsbereit.

Phosphat war überall – und es konnte fast alles. Es war der Funken, der Moleküle in Bewegung setzte, Brücken schlug, Reaktionen antrieb. Nicht umsonst blieb es die Energiewährung des Lebens – dieser universale Treibstoff jeder Zelle.
Aber damals war es noch Single.
Die große Vereinigung
Für den wilden Phosphat-Charakter war die Suche nach Partnern nicht einfach. Es liebäugelte mit Ribose, doch sie war eher instabil oder zu passiv durch ihren Borat-Beschützer. Und die Basen reagierten lieber mit sich selbst. Trockenheit und Magnesium eilten dem Phosphat zu Hilfe. Magnesiumionen umschmeichelten die negative Ladung – sie milderten Phosphats Reizbarkeit und erlaubten eine sanftere Annäherung. Verdunstendes Wasser presste die Moleküle zusammen.
Phosphat fand endlich Halt: Es umklammerte Ribose am fünften Kohlenstoff – ein stabiler Griff, der neue Reaktionen ermöglichte. Angelockt vom molekularen Ringelreihen näherte sich eine Base. Entschlossen griff sie das erste Kohlenstoffatom der Ribose und schwang sich dazu. Ein Zucken, ein Binden…
Aus drei wurde eins: das erste vollständige Nukleotid – die Grundeinheit der RNA.

Ein Nukleotid besteht aus drei Bausteinen: einem Phosphatrest (grün), einem Zucker namens Ribose (rosa) und einer stickstoffhaltigen Base (hier: Adenin, rot). Der Zucker trägt fünf Kohlenstoffatome (durchnummeriert 1′ bis 5′). Die Base ist am 1′-Kohlenstoff gebunden, das Phosphat am 5′-Kohlenstoff.
Die Verknüpfung der Ribose mit der Base und dem Phosphat erfolgt jeweils durch eine Kondensationsreaktion unter Abspaltung von Wasser (H2O). Dabei bilden sich eine „N-glykosidische Bindung“ (Base-Ribose, blaugrau) und eine „Phosphoesterbindung“ (Ribose-Phosphat, orange).
Geometrie, Chemie – und ein Hauch Zufall schmiedeten das Dreierbündnis aus Ribose, Base und Phosphat – vereint in einem Molekül. Ein winziger Triumph, doch einer, der die Tür zum Leben aufstieß.
Laborexperimente simulierten urzeitliche Bedingungen: Sie zeigten, dass unter den richtigen Bedingungen – etwa in mineralreichen, heißen Gewässern – Purin- und Pyrimidinbasen, Ribose und sogar vollständige Nukleotide abiotisch entstehen können. Sie nutzten wässrige Lösungen, vulkanische Hitze, Phosphat als Katalysator und Trocknungszyklen. Ihre Experimente bewiesen, dass die chemischen Pfade zu diesen Molekülen nicht nur möglich, sondern unter den Bedingungen der frühen Erde sogar wahrscheinlich waren. (Powner et al., 2009 und Becker et al., 2016)
Während in den Tümpeln die ersten Verbindungen entstanden, blickte der Himmel herab – und mischte sich ein. Meteoritenschauer krachten auf die Erde. Sie brachten neue Elemente, neue Impulse. Vielleicht sogar neue Ideen – in Form von Molekülen …
Szene 5: Sternenstaub & Einschläge – ein kosmischer Beitrag?
Interessanterweise könnten die Bausteine der RNA nicht nur auf der Erde entstanden sein. In Meteoriten wie dem berühmten Murchison-Meteoriten wurden Nukleobasen wie Uracil und Cytosin nachgewiesen (Callahan et al., 2011). Auch Ribose, Aminosäuren, Fettsäuren und Vorstufen von Lipiden fanden sich in diesen außerirdischen Gesteinsbrocken (Pizzarello et al., 2006). All das deutet darauf hin: Die Zutaten der RNA-Welt könnten einst aus dem All gekommen sein – ein kosmisches Geschenk an die junge Erde.
Meteoriten: Die ersten Lebens-Lieferdienste des Universums
Diese himmlischen Boten stammten aus der Urwolke, aus der vor 4,6 Milliarden Jahren auch unsere Sonne entstand. In den kalten, dunklen Regionen des frühen Sonnensystems – in molekularen Wolken, auf Kometen und Asteroiden – verwandelten UV-Licht und kosmische Strahlung einfache Moleküle wie Methan oder Ammoniak in komplexere organische Verbindungen (Bernstein et al., 2002).
Während des sogenannten Late Heavy Bombardment, vor etwa 4,1 bis 3,8 Milliarden Jahren, trafen unzählige Meteoriten die Erde. Mit ihnen regneten Aminosäuren, Zucker und andere organische Moleküle auf unseren Planeten – Rohstoffe des Lebens, verpackt als kosmische Sonderlieferungen. Auch Kometen wie 67P/Churyumov-Gerasimenko, erforscht durch die Raumsonde Rosetta, lieferten Bausteine wie Glycin und Lipidvorstufen (Altwegg et al., 2016). Sogar mikroskopisch feiner Staub – sogenannter Stardust – bringt bis heute jährlich Tausende Tonnen organischer Moleküle auf die Erde (Maurette et al., 2000).
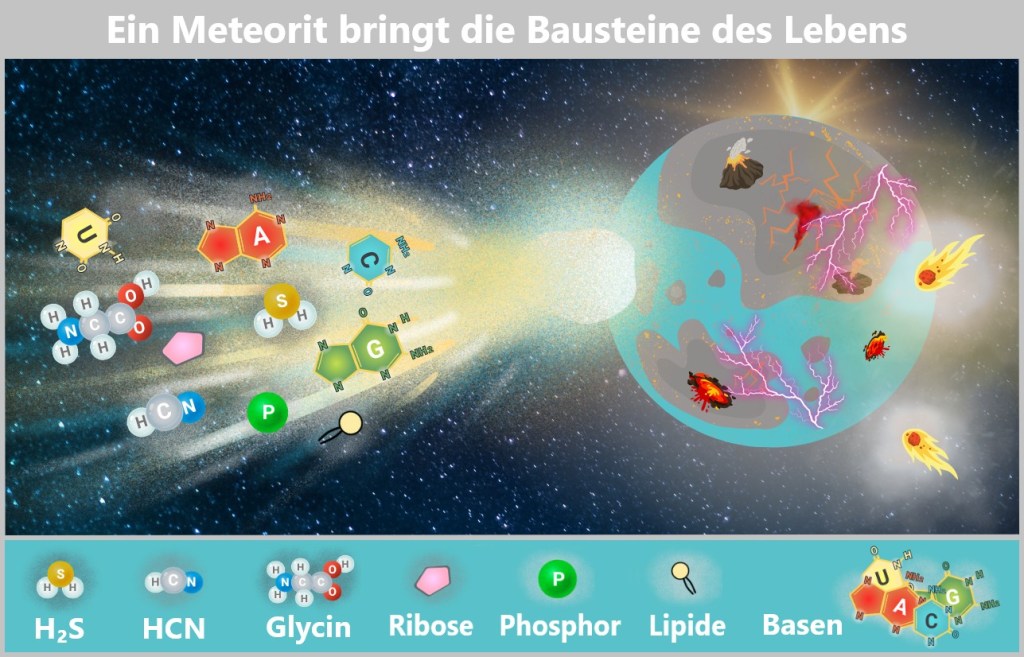
Nukleobasen wie Adenin, Guanin, Uracil und Cytosin sowie Ribose – die Grundbausteine der RNA. Auch Lipidvorstufen, Phosphorverbindungen und Glycin (die einfachste Aminosäure) gehören zum kosmischen Gepäck. Blausäure (HCN), ein zentraler Vorläufer organischer Verbindungen, könnte die chemische Evolution angestoßen haben. Diese Moleküle, geboren in den Herzen sterbender Sterne, regneten herab und bereicherten die Ursuppe – ein kosmischer Beitrag zum ersten Flüstern des Lebens.
Moleküle aus den Tiefen des Alls für die Ursuppe
Einmal auf der Erde gelandet, konnten diese Moleküle mit irdischen Stoffen zusammentreffen – und vielleicht die chemische Evolution befeuern. Die Einschläge selbst lieferten Energie: Hitze, Druck und Schockwellen, die Moleküle verbanden und neue Strukturen formten – vielleicht sogar erste Nukleotide.
Erstaunlich ist die Robustheit dieser Moleküle: Sie überstanden Jahrmillionen im Weltall, den glühenden Eintritt in die vulkanisch geprägte Ur-Atmosphäre, die Hitze beim Aufprall und die rauen Bedingungen der Urzeit.
Dieser kosmische Beitrag nährt die sogenannte Panspermie-Hypothese, die besagt, dass die Bausteine des Lebens aus dem All stammen könnten. Während die Idee, dass fertige Lebensformen die Erde erreichten, umstritten ist, unterstützt der Nachweis organischer Moleküle in Meteoriten die „weiche“ Panspermie: Die Erde wurde mit den Zutaten des Lebens beschenkt – Molekülen, die in den Herzen sterbender Sterne geboren wurden und über Äonen hinweg ihren Weg zu uns fanden.
Das Leben findet seinen Weg
Vielleicht ist Leben nicht bloßer Zufall – sondern die Folge einer chemischen Möglichkeit, tief verwurzelt im Bauplan des Universums. Staub aus Sternen, geboren in Explosionen längst verglühter Sonnen, sammelte sich, verband sich, tanzte in den Lichtfeldern ferner Welten. Wo immer die Bedingungen stimmten, begannen Moleküle sich zu ordnen, zu reagieren – und legten den Grundstein für das, was wir Leben nennen. Dass die Bausteine des Lebens an so vielen Orten entstehen konnten – auf Eiswelten, in tiefen Nebeln, in kosmischem Staub – erzählt von einer tiefen Wahrheit: Das Universum ist nicht kalt und leer. Es ist von Natur aus offen für das Wunder des Lebens.
2. Akt: Labore der Natur – Geburtsstätten der RNA
Die Zutaten lagen bereit, vom Himmel gefallen oder irdischen Ursprungs. Doch einzelne Bausteine machten noch kein Leben. Es fehlte der richtige Ort, um aus Bausteinen Ketten zu formen, aus Silben Worte entstehen zu lassen. Die frühe Erde bot viele Bühnen, doch zwei stechen hervor: Tiefsee-Schlote und trockene Tümpel mit mineralischen Wänden. Zwei Welten – jede ein eigenes Labor – gegensätzlich und doch vereint in ihrem schöpferischen Potenzial.
Szene 1: Die Schmiede der Tiefe – Hydrothermale Quellen
Tief im Ur-Ozean, wo tektonische Platten auseinanderdrifteten und die Erde Feuer atmete, öffneten sich Spalten im Meeresboden. Aufsteigende Magma wurde vom kalten Meerwasser gezähmt – daraus wuchsen „Schornsteine“, die hydrothermalen Quellen. Aus ihnen strömte heißes, mineralreiches Wasser – ein brodelnder Cocktail aus Schwefel, Metallen und Kohlenstoffverbindungen.
In diesem dampfenden Dunkel spielten sich Prozesse ab, die Leben vorbereiteten:
- Mineralische Oberflächen (z. B. Eisensulfide) wirkten als Katalysatoren.
- Hohe Temperaturen (70–150 °C) und starke chemische Gradienten lieferten Energie.
- Poröse Strukturen fingen Moleküle ein, schützten sie vor der zerstörerischen Kraft des Ozeans und konzentrierten sie – perfekte Bedingungen für Reaktionen.
Hier konnten sich Nukleotide bilden und verbinden – zu ersten kurzen RNA-Ketten (Wächtershäuser, 1988). Vielleicht war es hier, wo das erste Flüstern des Lebens erklang.

(Maßstabshinweis: Schlot-Durchmesser ~2 m; Mikrorisse <1 mm)
In einer urzeitlichen Unterwasserlandschaft steigen schwarze Rauchfahnen aus hydrothermalen Schloten empor – den sogenannten „Black Smokers“. Magma erhitzt mineralreiches Wasser, das aus dem Meeresboden schießt. Die porösen Gesteine sind von feinen Rissen durchzogen, in denen chemische Reaktionen stattfinden. Ein vergrößerter Ausschnitt (weiß umrandet) zeigt, was sich in diesen Mikrolabors abspielen könnte: Organische Bausteine wie Nukleobasen (A, U, G, C), Ribose und Phosphate treffen aufeinander. Blitze symbolisieren Energie, die Reaktionen antreibt – etwa die Bildung von Nukleotiden. Rechts entsteht daraus eine kurze RNA-Kette – der mögliche Anfang des Lebens.
Szene 2: Die Alchimie des Tons – Geburtsstätten an Land
Weit entfernt von den Tiefen des Ozeans, in flachen Tümpeln und an vulkanischen Ufern, ruhte eine andere Bühne. Hier lag feiner Ton – entstanden aus Vulkanasche, geschichtet wie die Seiten eines Buches. Diese Tonminerale hatten eine besondere Architektur: negativ geladene Silikat-Oberflächen, dazwischen positiv geladene Ionen wie Natrium (Na⁺) oder Calcium (Ca²⁺).
Was sich in diesen Schichten sammelte, war nicht zufällig. Die negativ geladenen Oberflächen zogen positive Partner magisch an: Ribose, gebunden an Borat; stickstoffhaltige Basen; und später ganze Nukleotide. Selbst die negativ geladenen Phosphatgruppen fanden Halt – gebunden an die positiven Ionen des Tons.
Eine rhythmische Abfolge von Nässe und Trockenheit presste die Moleküle zusammen. Mit jeder Verdunstung rückten die Bausteine enger zusammen, bis sie sich verknüpften: zuerst Ribose & Base zu einem Nukleosid, dann – mit dem Phosphat – zu einem Nukleotid. Mit fortschreitenden Zyklen verknüpften sich die Nukleotide zu ersten RNA-Ketten. Der Ton leitete das Geschehen – er war Bühne, Werkzeug und Regisseur zugleich. Und er urteilte auch – denn nur die stabilsten Nukleotideüberstanden das Spiel der Elemente. Eine erstaunliche Leistung für ein bisschen Ton.

Im Schatten urzeitlicher Vulkane verwitterten Gesteine. Daraus entstanden feinschichtige Tonschichten, die sich in flachen Tümpeln ablagerten. In ihrer polarisierten Struktur wirkten sie wie molekulare Werkbänke: Sie ordneten, konzentrierten und stabilisierten organische Bausteine.
Im vergrößerten Ausschnitt sieht man, wie die geladenen Flächen der Tonschichten Ribose, Phosphatgruppen und Basen festhalten – wie Teile eines Puzzles, das sich selbst zusammensetzt. Durch wiederholte Zyklen von Nässe und Trockenheit rücken die Moleküle enger zusammen. Dabei entstanden zunächst Nukleoside, dann ganze Nukleotide – bis schließlich RNA-Ketten wachsen konnten.
In Experimenten zeigte James Ferris (2006), dass Montmorillonit – eine häufige Tonart – diese Prozesse tatsächlich unterstützen kann: Nukleotide lagerten sich in seinen Schichten ab, wurden aktiviert und verknüpften sich zu RNA-Ketten von bis zu 50 Nukleotiden Länge.
In der Tiefsee war es die Hitze, die Moleküle belebte – ein urzeitlicher Ofen, in dem Chemie zu Struktur fand. An Land dagegen wirkte der Ton wie ein Webstuhl: beharrlich, schichtend, verbindend. Zwei Welten, zwei Prinzipien – und doch vielleicht Teil eines größeren Ganzen.
Szene 3: Viele Wege, ein Ziel
Ob in brodelnden Tiefseequellen oder auf stillen Tonflächen unter der Sonne – beide Schauplätze boten plausible Bühnen für die Geburt der RNA. Vielleicht ergänzten sie einander: Was der Ozean begann, vollendete das Land. Oder umgekehrt. Vielleicht gab es noch ganz andere Wege.
Denn die frühe Erde war kein aufgeräumtes Labor mit Protokoll – sie war ein chaotischer Spielplatz der Elemente. Überall experimentierte die Natur: mit Hitze und Kälte, Stein und Salz, Trockenheit und Flut. Manche Wege führten ins Nichts – Moleküle zerfielen, ohne eine Spur zu hinterlassen. Andere wiederholten sich – nicht, weil sie geplant waren, sondern weil sie funktionierten.
So entstanden erste chemische Routinen, molekulare Gewohnheiten. Mit jeder Wiederholung wuchs ihre Wahrscheinlichkeit – und ihre Wirkung. Und mit jeder Kette, die sich bildete, rückte ein neues Kapitel des Lebens näher.
Vielleicht waren es am Anfang nur wenige Glieder: kurze RNA-Fragmente, erste Worte – noch ohne Sinn – eher ein Murmeln. Doch sie trugen bereits das Versprechen künftiger Komplexität.
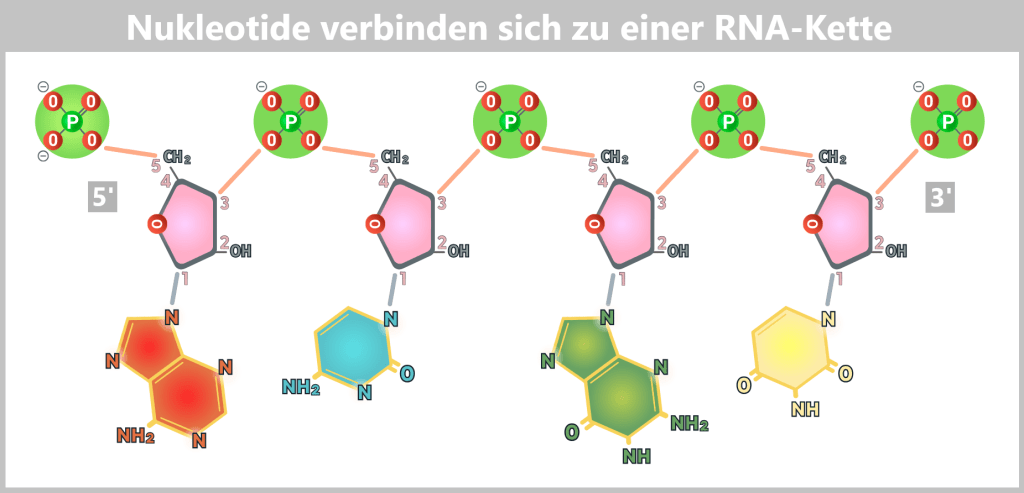
Die Bausteine:
Farbcodierte Basen (rot: Adenin, blau: Cytosin, grün: Guanin, gelb: Uracil)
Ribose-Zucker (rosa) als stabile „Wirbelsäule“
Phosphatgruppen (grün) als verbindende „Gelenke“
Die Bindungen:
Phosphodiesterbindungen (orange):Phosphat ↔ Ribose
N-glykosidische Bindung (blaugrau): Ribose ↔ Base
Die Richtung:
Die RNA-Kette wächst immer von 5′ nach 3′ – weil die Chemie keine Wahl ließ. Wie ein Reißverschluss, der sich nur in eine Richtung schließen lässt, verknüpften sich Nukleotide Baustein für Baustein.
Kurze RNA-Fragmente wie dieses könnten unter präbiotischen Bedingungen entstanden sein:

Das Rätsel der enzymfreien Polymerisation
Trotz dieser vielversprechenden Reaktionsräume bleibt eine Frage offen: Wie konnten sich Nukleotide zu längeren RNA-Ketten verbinden – ganz ohne Enzyme, die solche Prozesse heute präzise steuern?
Damit eine RNA-Kette entsteht, muss die Phosphatgruppe eines Nukleotids mit dem Zucker eines anderen reagieren – unter Abspaltung von Wasser, eine sogenannte Dehydratisierungsreaktion. Doch ausgerechnet in der wasserreichen Urerde war das ein Problem: Wasser kehrt diese Reaktion leicht um. Auch die nötige Energie war rar – jenes ATP (Adenosintriphosphat), das heute als universeller Energieüberträger alle Lebensprozesse antreibt, existierte damals noch nicht.
Und doch gibt es Hoffnungsschimmer: In hydrothermalen Quellen könnten Temperaturzyklen – abwechselnd heiß und kalt – das Wasser aus winzigen Poren verdrängt und so Reaktionen begünstigt haben. Mineralien wie Montmorillonit oder Eisensulfide könnten durch chemische Gradienten oder Elektronentransfer Energie bereitgestellt haben. Und einfache Verbindungen wie Cyanamid, die in präbiotischen Simulationen entstehen, wirken möglicherweise als primitive „Aktivatoren“ (Sutherland, 2016): Sie erleichtern die Verknüpfung von Nukleotiden.
Experimente zeigen: Unter solchen Bedingungen können sich tatsächlich kurze RNA-Ketten bilden – meist nur wenige Nukleotide lang. Wie aus diesen Fragmenten einst längere, funktionale RNA-Moleküle entstanden, bleibt eines der letzten großen Rätsel der chemischen Evolution.
Doch selbst die kürzesten RNA-Ketten bargen ein Geheimnis: Sie waren mehr als nur Chemie – sie waren Botschaften in Warteposition. Wo sich Basen aneinanderreihten, entstand ein Code. Und wo ein Code ist, da liegt Vervielfältigung in der Luft …
3. Akt: Die ersten Selbstreplikatoren erwachen
Tief in den geschützten Winkeln der jungen Erde – vielleicht in den warmen Ritzen eines Gesteins, vielleicht in Pfützen aus Schlamm, durchtränkt von organischen Stoffen – waren die ersten RNA-Moleküle entstanden: Ketten aus Nukleotiden, aufgebaut aus Basen, Ribose und Phosphatgruppen. Sie waren kurz, vielleicht 30 oder 50 Glieder lang. Doch sie konnten etwas, das alles veränderte:
Sie begannen, sich zu vervielfältigen.
RNA – ein Molekül mit zwei Gesichtern
RNA war nicht bloß Materie – sie war Information und Aktion zugleich.
Eine Doppelrolle – zwei Talente:
❶ Ihre Basenfolgen – A, U, C und G – trugen Information, wie Worte einen Gedanken.
❷ Und sie beschleunigte chemische Reaktionen – wie ein Enzym, nur ohne Protein.
Eine Kombination, wie sie kein anderes Molekül je zuvor vereint hatte.
Szene 1: Von der Kette zum Werkzeug – RNAs funktionelle Reifung
Am Anfang war RNA nur ein einsamer Strang, der in der Ursuppe vor sich hinblubberte – bis er begann, Selbstgespräche zu führen: A suchte U, G verbandelte sich mit C – und wo sich mindestens vier Basen fanden, zogen die Wasserstoffbrücken die Kette in eine neue Form (siehe Abb. 14). Stabilisiert von Magnesiumionen (wie unsichtbare Klammern, siehe Abb. 15-B) faltete sie sich wie molekulares Origami – es entstanden Schleifen und Stämme (Doppelstrang-Abschnitte).
Doch diese Faltung war mehr als nur eine geometrische Laune. An den Knickstellen, wo die Basenpaarung endete, entstand etwas Revolutionäres: Eine katalytische Tasche – eine Mulde, gerade groß genug, um Moleküle zu umschließen, und dennoch so exakt, um Reaktionen zu ermöglichen.
Nicht jede Faltung führte zu einer aktiven Struktur. Doch wenn Sequenz, Länge und Milieu harmonisierten, wurde aus der simplen Kette ein Ribozym:
➤ Ein Werkzeug, das seine eigene Existenz vorantrieb.
➤ Ein Katalysator, geboren aus Form und Funktion.

Komplementäre Bereiche der RNA binden aneinander und bilden einen Doppelstrang (Stamm), während sich dazwischen eine Schleife ausbildet. In dieser entsteht eine sogenannte Tasche – ein aktives Zentrum, in dem chemische Reaktionen möglich sind. Die Darstellung ist stark vereinfacht und zeigt die Faltung in 2D, obwohl die RNA in der Realität eine komplexe dreidimensionale Struktur annimmt.
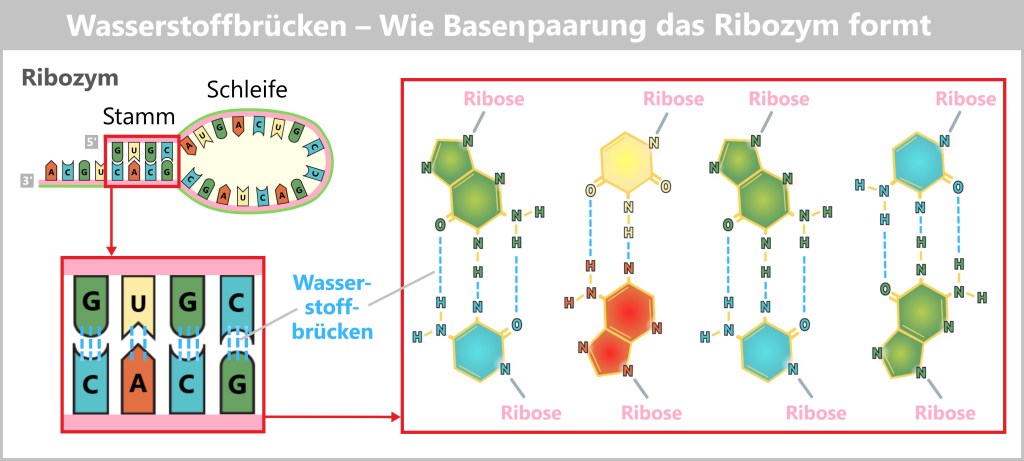
Die Grafik zeigt den Stamm eines Ribozyms, in dem sich komplementäre Basen über Wasserstoffbrücken (gestrichelte hellblaue Linien) zusammenlagern:
Guanin (G) und Cytosin (C) über 3 Wasserstoffbrücken,
Adenin (A) und Uracil (U) über 2 Wasserstoffbrücken.
Dabei wirken einzelne Wasserstoffatome (H) wie molekulare „Brückenpfeiler“ – sie verbinden zwei Basen, indem sie sich zwischen ihnen aufteilen. So wird aus einer linearen RNA-Kette eine gefaltete Struktur.
Wie lief die Selbstreplikation ab?
Selbstreplikation bedeutet, dass ein RNA-Molekül eine Kopie von sich selbst herstellt – ein Prozess, der in der RNA-Welt langsam und fehleranfällig, aber revolutionär war.
Szene 2: Die Kraft der Faltung
Die Faltung war entscheidend: Nur wenn sich bestimmte Schleifen und Stämme richtig formten, entstand eine „Tasche“, in der Reaktionen möglich wurden. In dieser „Tasche“ lagerten sich freie Nukleotide aus der Umgebung an – schwach gebunden durch Basenpaarung (A an U, G an C).
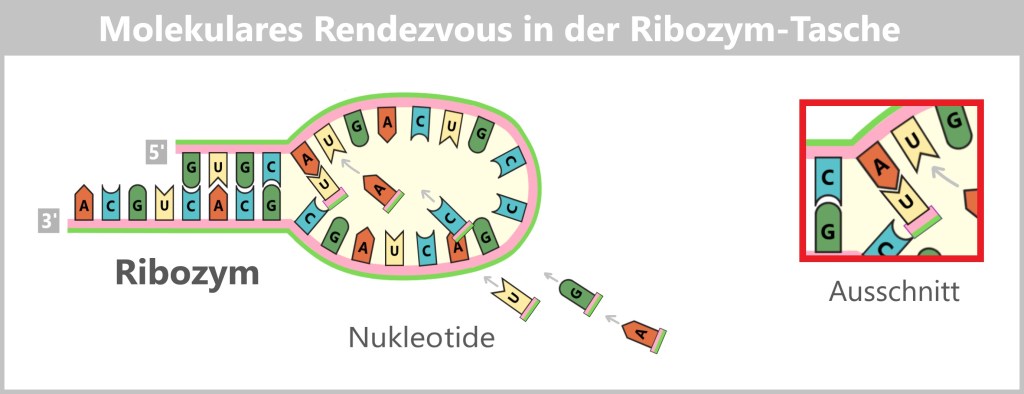
Die RNA-Kette besteht aus den Basen Cytosin (C), Adenin (A), Uracil (U) und Guanin (G). C ist Teil des Stamms, der durch Basenpaarung stabilisiert ist. A, U und G sind die ersten RNA-Bausteine in der Schleife – dem aktiven Zentrum des Ribozyms.
Magnesiumionen (Mg²⁺) – unsichtbare Helfer des Ribozyms – richteten die Nukleotide aus, indem sie negative Ladungen abschirmten. Die 3′-OH-Gruppe (der Ribose) des letzten Nukleotids und das α-Phosphat des neuen Nukleotids lagen nun genau auf Kollisionskurs.
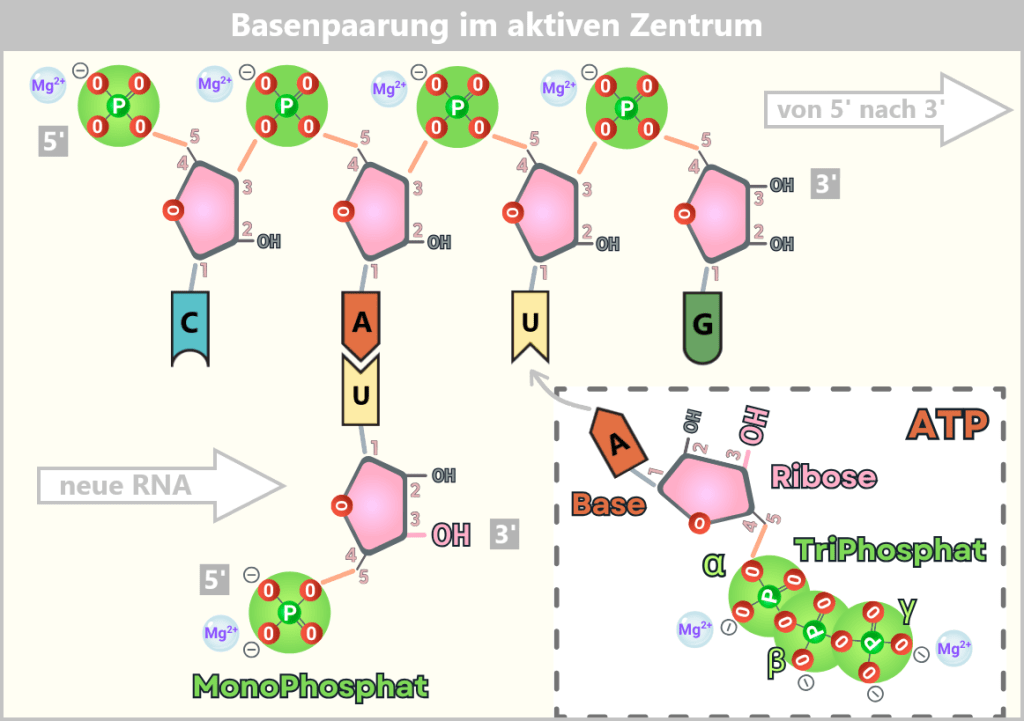
(Vergrößerung der Abb. 15-A)
Die Abbildungen 15-A und 15-B zeigen einen Abschnitt der RNA-Selbstreplikation durch ein Ribozym. An das Adenin (A) hat sich bereits ein Uracil (U)-Nukleotid angelagert – der erste RNA-Baustein der neuen RNA-Kette. Seine freie 3′-OH-Gruppe steht bereit für die Verknüpfung mit dem nächsten Nukleotid. In einigen Modellen der RNA-Welt trägt dieses erste Nukleotid nur ein MonoPhosphat – es dient als Anker, ohne gleich verknüpft zu werden. Ein A-Nukleotid (ATP) nähert sich dem komplementären Uracil. Es bringt ein TriPhosphat mit – die molekulare Energiewährung für den nächsten Schritt der Replikation.
Szene 3: Der energetische Pakt
Es war der Moment der Wahrheit: Der nächste Baustein sollte fest angehängt werden. Die RNA brauchte dafür keinen externen Antrieb – in ihren eigenen Nukleotiden trug sie den Treibstoff für ihre Vermehrung. Denn bei ihrer Entstehung aus der Ursuppe bekam jedes Nukleotid von Haus aus drei energiereiche Phosphatgruppen mitgeliefert – wie ein Geschenk der präbiotischen Chemie. Jedes neue Nukleotid (wie ATP – Adenosin-Tri-Phosphat) kam beladen mit einer Dreifachladung aus Phosphaten – eine chemische Sprungfeder, gespannt bis zum Zerreißen.
Doch diese Feder wartete. Erst wenn das Nukleotid seine komplementäre Position gefunden hatte – wenn die Basen sich erkannt, verbunden, festgehalten hatten – rückte das α-Phosphat nah genug an die 3′-OH-Gruppe des wachsenden Strangs. In dieser molekularen Nähe, dieser Intimität des Augenblicks, geschah es: Die OH-Gruppe griff zu, das Pyrophosphat (PPi: zwei Phosphatreste) schleuderte davon wie eine abgeworfene Raketenstufe – und mit der freiwerdenden Energie besiegelte sich der Bund. Die Feder schnappte zurück, drängte die Moleküle zueinander, und in einer letzten, unwiderstehlichen Bewegung verschmolzen sie: eine Phosphodiesterbindung war geboren.

Die Grafik enthüllt den intimen Moment der Replikation:
➤ Ein Uracil-Nukleotid (U) hat sich bereits an sein Adenin-Pendant (A) geschmiegt.
➤ ATP naht – sein Triphosphat-Schwanz zuckt vor Energie. Im aktiven Zentrum des Ribozyms kommen sich die 3′-OH-Gruppe (der Ribose) und das α-Phosphat nahe.
➤ Der Angriff: Die OH-Gruppe stürzt sich auf das Phosphat – PPi fliegt frei, die neue Bindung schnappt ein.
➤ Magnesiumionen (Mg²⁺) mildern die Abstoßung der Phosphate.
So wurde der Zufall zur Tradition: Was einst ein glücklicher Unfall der Ursuppe war – jenes Triphosphat-Anhängsel der Nukleotide –, erwies sich als genialer Dauerbrenner. Milliarden Jahre später wiederholt jede deiner Zellen denselben Trick, nun mit verfeinerter Logistik: Sie baut Nukleotide in sparsamer Einfachversion, um sie dann, wie einst die präbiotische Chemie, mit einer Dreifachladung zu versehen. Nur dass heute ATP als gezählte Münze dient – doch der Mechanismus blieb unverändert. Als hätte das Leben sein erstes Patent nie zurückgegeben.
Die List der Thermodynamik: Das flüchtige PPi war der Schlüssel – sein Zerfall in der Ursuppe machte die Reaktion unumkehrbar. Die Kette wuchs, Nukleotid für Nukleotid, angetrieben von einer Selbstausbeutung der Moleküle.
Szene 4: Partielle Replikation
Die Replikation war nicht vollständig: Im Ribozym waren einige Abschnitte – wie der Stamm – durch Basenpaarung besetzt und konnten nicht als Vorlage dienen. Nur ungepaarte Bereiche, etwa die Schleifen, wurden kopiert. So wurde nicht der ganze Code übertragen, nur Fragmente: 10, 20, manchmal 50 Nukleotide lang. Winzig? Ja. Doch in der Ursuppe, wo jedes Molekül um sein Dasein kämpfte, war selbst eine verkürzte Kopie ein Triumph.
Die Natur schrie nicht: „FEHLER: UNVOLLSTÄNDIGE REPLIKATION“. Sie flüsterte: „Wiederhole. Probier’s nochmal.“ Und so geschah es: Solange die Suppe Nukleotide hergab, ratterte die Maschine weiter – mal stockend, mal überraschend flink – und schrieb dabei unbeirrt ihre eigene Evolution in den Code.
Szene 5: Trennung – ein Abschied, der Neues schuf
Die Kopie war erstellt, alte und neue Klette – noch ineinander verschlungen. Doch die Welt um sie herum war ungeduldig:
➤ Hitze schob sie auseinander, Molekül für Molekül.
➤ Salzfluten spülten dazwischen, ließen Wasserstoffbrücken erschlaffen.
➤ Verdunstung zerrte an ihnen, bis die letzten Basenpaare nachgaben.
Und dann ließen sie sich los. So ganz frei waren sie nun bereit für den nächsten Zyklus. Denn Trennung war hier nur die Chance, neu anzufangen.

Szene 6: Von kleinen zu längeren Ketten: Die Macht der Ribozyme
Mit der Vielfalt der Formen wuchs auch das Potenzial der Funktionen.
Einige Ribozyme konnten mehr als nur replizieren: Sie konnten Fragmente verbinden. Zwei Stücke zu einem. 20 plus 20 ergab 40 Nukleotide – eine Verdopplung der Möglichkeiten. Vielleicht halfen Aminosäuren: nicht als Bausteine, sie stabilisierten die Faltung, wie neue Studien nahelegen (Szostak et al., 2025).
Andere Ribozyme schnitten RNA in Stücke und setzten sie neu zusammen. Über viele Zyklen von Replikation, Ligation und Bearbeitung wuchs so Schritt für Schritt ein Werkzeugkasten der Moleküle – fähig zu kombinieren, zu verlängern, zu verändern.
Das Spiel mit der Form hatte begonnen – und mit ihm die erste Regel des Lebens: Wer sich verbindet, überdauert.
Ein evolutionäres Erbe: Beweise aus unserer Zeit
Die Fähigkeit der RNA, sich selbst zu replizieren, zu schneiden und zu verknüpfen, war nicht nur in der Urzeit entscheidend – sie hat bis heute Spuren hinterlassen. In den 1980er Jahren zeigten Sidney Altman und Thomas Cech, dass RNA Moleküle schneiden und verändern können, ganz ohne Proteine – eine Entdeckung, die ihnen 1989 den Nobelpreis für Chemie einbrachte.
Auch andere Experimente stützen die RNA-Welt-Hypothese: Gerald Joyce und Jack Szostak entwickelten im Labor RNA-Moleküle, die sich selbst replizieren konnten – langsam, fehleranfällig, aber funktional.
Faszinierenderweise finden wir Relikte dieser RNA-Welt in unseren heutigen Zellen: Beim RNA-Spleißen, einem Prozess, bei dem nicht-codierende Abschnitte (Introns) aus der Boten-RNA entfernt und die codierenden Segmente (Exons) verbunden werden, ist der zentrale Akteur ein Ribozym – das Spleißosom.
Und das vielleicht Erstaunlichste: Im Herzen des Ribosoms – jener molekularen Maschine, die all unsere Proteine baut – sitzt kein Protein, sondern ein Ribozym.
📖 Quellen:
„Scientist Stories: Thomas Cech, Discovering Ribozymes”
„The ribosome is a ribozyme”, Cech, 2000
„RNA, the first macromolecular catalyst: the ribosome is a ribozyme”, Steitz & Moore, 2003
„Ribozyme Structure and Activity”
Vielleicht ist das Ribosom mehr als ein Relikt – es ist ein Botschafter aus einer Zeit, als Chemie begann, sich selbst zu lesen. Und in jedem unserer Proteine schwingt noch das Echo dieser ersten, zaghaften Selbstgespräche des Universums.
Szene 7: Fehler als Chance: Der Motor der Evolution
Die Replikation dieser frühen RNA-Moleküle war nicht perfekt: Oft wurden Basen falsch eingebaut – vielleicht ein U statt eines C, was zu Mutationen führte. Doch diese Fehler waren kein Ende, sondern ein Anfang.
Manche neuen RNA-Moleküle zahlten den Preis: Sie fielen auseinander, verloren sich in der Ursuppe. Manche neuen RNA-Moleküle waren stabiler oder replizierten sich schneller – sie „überlebten“ länger in der rauen Umgebung der jungen Erde.
Die Fehler streuten Vielfalt in die Welt – sie wurden zur Grundlage für Selektion. Mit der Zeit entwickelten sich Ribozyme, die effizienter replizierten, besser ligierten oder präziser schnitten, was die Bildung längerer und komplexerer Ketten förderte. So entstanden erste Populationen von Molekülen, die sich, wenn auch langsam, vervielfältigten. Keine Zelle, kein Enzym, kein Plan: nur RNA, Chemie und Zeit.
Grenzen der Freiheit
Mit jeder neuen Kopie wuchs das Risiko. Die Umgebung war gnadenlos, geradezu ein Schlachtfeld: UV-Strahlen zerschlugen Bindungen, salzige Fluten destabilisierten Strukturen, Hitze ließ selbst stabile Faltungen schmelzen. Die freie RNA war ein Wunder – aber ein verletzliches. Was jetzt fehlte, war nicht nur Energie oder Material. Es fehlte ein Rückzugsort. Ein Schutz, der das empfindliche Molekül vor dem Chaos bewahrte. Ein Tropfen. Eine Hülle. Ein erstes Innen und Außen – damit Leben nicht nur entsteht, sondern bleibt.
4. Akt: Leben im Tropfen – Lipidvesikel als Schutzräume
Die RNA – zerbrechlich wie ein erstes Wort im Sturm – brauchte mehr als nur eine Idee vom Leben. Sie brauchte einen Ort zum Überdauern. Einen Schutz vor dem rauen Rhythmus der Welt.
Szene 1: Die ersten Festungen
In den warmen Wassern der frühen Erde – an hydrothermalen Schloten oder auf mineralischen Lehmbänken – tanzten fettartige Moleküle miteinander: Lipide, geboren aus der organischen Ursuppe. Diese Moleküle waren doppelseitig – amphiphil: mit einem wasserliebenden (hydrophilen) Kopf und einem wassermeidenden (hydrophoben) Schwanz. Ganz ohne Plan, nur durch physikalische Gesetze, schlossen sie sich zu kleinen Bläschen – kugeligen Bollwerken – zusammen: den ersten Lipidvesikeln.
Es waren keine perfekten Kugeln. Sie waren holprig, porös, mit Dellen und Rissen – gezeichnet von den wilden Bedingungen ihrer Zeit. Aber sie boten, was RNA dringend brauchte:
➤ Schatten – ihre Doppelmembran dämpfte die tödliche UV-Strahlung. Nicht vollkommen, aber ausreichend.
➤ Schutz – sie milderten extreme pH-Schwankungen und Salzfluten, die RNA sonst zerfetzt hätten.
➤ Stille – in ihrem Inneren sammelten sich Nukleotide. Kein offenes Meer mehr – ein abgeschlossener Raum – in dem Replikation kein Glücksspiel mehr war, sondern Strategie.

Die Grafik zeigt den Übergang von einfachen Fettsäuren zu schützenden Strukturen:
Links: Kurzkettige Buttersäure (C4). Ihre kurzen Schwänze (<C6) zwingen sie zu instabilen Mizellen – winzigen Kugeln ohne Innenraum, ungeeignet als Schutzschilde.
Rechts: Mittelkettige Decansäure (C10). Ihre längeren hydrophoben Schwänze formen stabile Doppelschichten – die ersten echten Vesikel, die RNA einschließen konnten.
Randnotiz: Physikalische Selbstorganisation – Ordnung ohne Bauplan
Manchmal braucht es keinen Architekten, keinen Bauplan, keine chemische Reaktion – nur die richtigen Bausteine am richtigen Ort. So ist es mit Lipiden:
Wenn fettähnliche Moleküle ins Wasser kommen, passiert etwas Überraschendes: Sie ordnen sich ganz von selbst. Warum? Weil sie widersprüchlich gebaut sind:
- Ihr Kopf liebt Wasser (hydrophil),
- ihr Schwanz hasst Wasser (hydrophob).
Im Wasser wollen die Moleküle diesen Konflikt lösen – und sortieren sich so, dass die Köpfe nach außen (zum Wasser) und die Schwänze nach innen zeigen (weg vom Wasser). Das Ergebnis? Kugeln, Schichten, Hüllen – ohne chemische Reaktion, nur durch physikalische Kräfte wie:
- den hydrophoben Effekt (Wasser meidet fettige Bereiche),
- elektrostatische Anziehung,
- und Van-der-Waals-Kräfte zwischen Molekülen.
So entstehen Lipidvesikel – ganz ohne Enzyme, ohne Energiezufuhr, nur mit dem, was die Natur immer zur Hand hat: Wasser, Bewegung, Moleküle – und Zeit.
Die Gesetze der Thermodynamik diktierten den Lipiden, wer sich zu Vesikeln formieren durfte. Wer zu kurz war, zerfiel. Wer zu starr war, zerbrach. Nur jene mit den Goldlöckchen-Eigenschaften – nicht zu kurz, nicht zu lang, nicht zu hydrophil – bildeten stabile Hüllen, robust genug, um RNA zu schützen. Sie überstanden die rauen Bedingungen lange genug, um zu Gründern einer neuen Ordnung zu werden.
Laborexperimente bestätigen: „Fatty acid vesicles self-assemble readily from C10 and longer chains, while shorter chains (≤C8) fail to form stable compartments – a possible bottleneck for the emergence of protocells.“ (Szostak et al., 2001)
(Fettsäurevesikel lassen sich leicht aus C10- und längeren Ketten zusammensetzen, während kürzere Ketten (≤C8) keine stabilen Kompartimente bilden können – ein möglicher Engpass für die Entstehung von Protozellen.)
Diese Ur-Lipide waren keine perfekten Baumeister: ungerade Kettenlängen, eine lückenhafte Anordnung, Verzweigungen und Oxidationen. Doch genau diese Unordnung machte sie flexibel genug, um Hitze und Salz zu ertragen und RNA-Moleküle aufzunehmen – und so den ersten Mikrokosmos des Lebens zu schaffen.
Szene 2: Der Eintritt – Verschleppung oder Einwanderung?
Die Entstehung der Lipidvesikel war ein natürlicher Prozess. Doch was nützt ein Haus ohne Bewohner? Zwei Wege zeichneten sich ab:
Verschleppung beim Entstehen: Dort, wo die Lipide entstanden, war das Wasser oft schon reich an RNA-Bruchstücken. Beim Zusammenziehen der Lipide wurden kleine Mengen an RNA und Nukleotiden zufällig mit eingemauert – wie Laub in einer zufrierenden Pfütze.
Einwanderung durch Lücken: Diese ersten Membranen waren keine undurchdringlichen Mauern – eher löchrige Netze. Kleine Moleküle wie Nukleotide, ja selbst kurze RNA-Ketten, konnten durchschlüpfen (Szostak et al., 2001). Vielleicht spülten Strömungen sie hinein. Vielleicht trieben Temperaturschwankungen oder chemische Gradienten sie durch die Membran. Es war ein stetes Kommen und Gehen, ein ständiger chemischer Pulsschlag.
Diese Hüllen waren porös, elastisch, durchlässig. Sie schlossen nichts aus – sie luden ein. Und mit jedem Eintritt wuchs die Chance: auf Reaktion, auf Replikation, auf mehr. Hier fand die RNA ein erstes Zuhause. Noch kein Leben – aber ein Ort, an dem es möglich wurde.
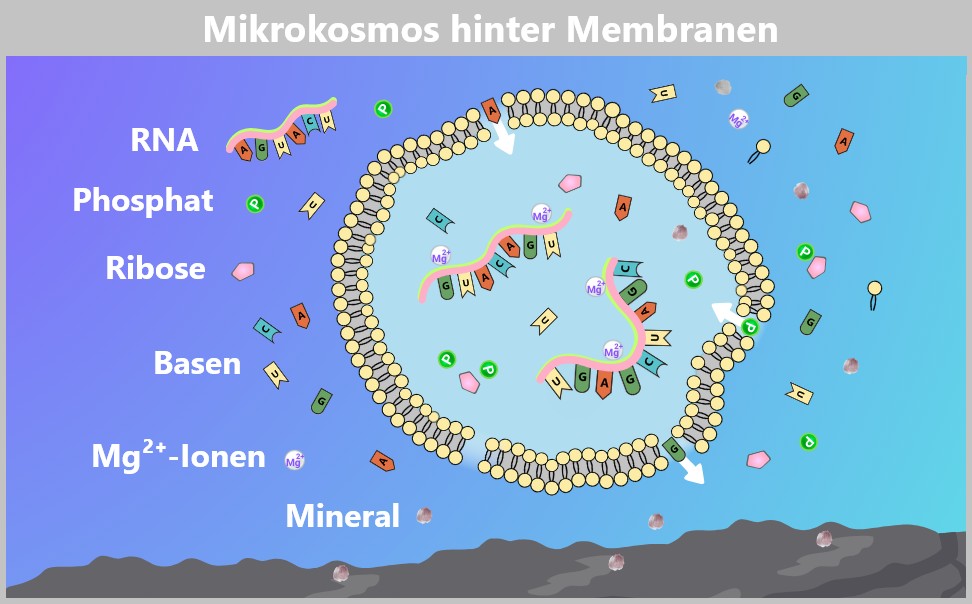
Die Grafik zeigt ein Lipidvesikel in einem hypothetischen präbiotischen Gewässer. Amphiphile Lipide (gelbe Doppelkugeln) bilden spontan eine Lipiddoppelschicht und umschließen dabei RNA-Moleküle. Einzelne RNA-Bausteine – Phosphate (grün), Ribose (rosa) und Basen (A, U, C, G) – befinden sich sowohl innerhalb als auch außerhalb des Vesikels. Pfeile zeigen mögliche Diffusionswege kleiner Moleküle durch die durchlässige Membran. Mineralpartikel (graue Punkte) sind über das Wasser verteilt, könnten aber auch als Reaktions- oder Adsorptionsflächen am Boden wirken. Das Vesikel bietet RNA-Molekülen Schutz vor dem Abbau und fördert durch lokale Konzentration die Replikation – ein möglicher Schritt auf dem Weg zur Entstehung erster protozellulärer Systeme.
Szene 3: Der Pakt – RNA stabilisiert, Vesikel schützen
Im Innern der Vesikel begann eine stille Allianz.
Die RNA, übersät mit negativen Ladungen, lockte Magnesiumionen (Mg²⁺) an – und diese wurden zu Stützen. Sie stabilisierten nicht nur die zitternde Faltung der RNA, sondern kitteten auch die Lipidmembran wie Mörtel zwischen Ziegeln (Chen & Szostak, 2004). Das Ergebnis: Ein Gefäß, das Strömungen, osmotischen Schocks und Hitze trotzte – RNA-gefüllte Vesikel überlebten, wo leere zerfielen (Hanczyc et al., 2003).
Und die RNA blieb nicht passiver Mieter. Ribozyme, unbeholfen wie erste Werkzeugmacher, begannen Lipidvorläufer zu verändern – schnitten, fügten, experimentierten (Adamala & Szostak, 2013). Die Membran wurde dichter, geschmeidiger, als lernte sie atmen. Vesikel mit RNA wuchsen rascher, teilten sich bei kritischer Größe – ein Selbstläufer der Natur (Budin & Szostak, 2011).
Und dann der osmotische Sog: RNA band Wasser wie ein Schwamm, dehnte die Hülle zum Zerreißen – bis sie platzte und neue Vesikel gebar (Sacerdote & Szostak, 2005). Leere Vesikel dagegen verloren Wasser, sie schrumpften wie vertrocknete Früchte.
Was entstand, war mehr als Schutz. Es war eine wechselseitige Stärkung – eine Proto-Symbiose – ein Deal, der die Spielregeln änderte: Die Lipide bewahrten die RNA vor dem Zerfall, die RNA stabilisierte die Lipide gegen das Chaos der Außenwelt (Black & Blosser, 2016). Als Team waren sie stärker als allein.
Szene 4: Die Chance der Unvollkommenheit
Trotz ihrer Vorteile waren die frühen Vesikel keine sicheren Häfen:
- Ihre Wände zitterten bei Temperaturstürzen.
- Salzfluten brannten Löcher in ihre Membranen.
- pH-Schwankungen ließen sie zerfließen wie Wachs in der Sonne.
Und doch: Gerade ihre Fehler wurden zum Antrieb.
- Durchlässigkeit ließ Nukleotide hinein – aber auch RNA hinaus. Ein riskanter Handel.
- Instabilität zwang sie zum Wachsen, Teilen, Scheitern und Neuversuchen.
Was überlebte, war weder das Stärkste noch das Schnellste – sondern das, was mit Unordnung tanzen konnte:
- Vesikel mit flexibleren Lipiden.
- RNA-Stränge, die Magnesiumionen effizienter banden.
- Systeme, die Verlust in Variation verwandelten.
Perfektion war der Feind des Fortschritts. Nur wer löchrig blieb, ließ das Leben durch.
Szene 5: Selektion im Tropfen
In diesem Mikrokosmos aus Öl und Wasser begann ein erbarmungsloses Spiel:
➤ Die Glücklichen: Vesikel, deren RNA Magnesiumionen band oder Lipide umbaute – sie wuchsen, teilten sich, und gaben ihr funktionales Design weiter.
➤ Die Vergesslichen: Leere Tropfen, ohne Inhalt, ohne Geschichte. Sie schrumpften, zerfielen – als ob es sie nie gegeben hätte.
➤ Die Gescheiterten: Vesikel mit instabiler RNA – sie platzten und versprengten ihre Bruchstücke in die Umgebung.
In diesem Entstehen und Vergehen bekam der Zufall Richtung: Vesikel mit stabiler RNA hatten höhere Überlebenschancen. Nach dem Platzen setzten sie ihre RNA frei, die neue Vesikel besiedeln konnte – ein einfacher Evolutionskreislauf aus Wachstum, Teilung und Selektion.

In der rauen Umgebung der frühen Erde unterliegen Lipidvesikel einem dynamischen Zyklus, der den Ursprung präbiotischer Evolution markiert. Durch die Zufuhr von Lipiden aus der Umgebung – etwa Fettsäuren, die sich in die Lipiddoppelschicht einlagern, Temperaturschwankungen, die die Vesikel ausdehnen und durchlässiger machen, oder osmotischen Druck, der durch RNA und Ionen im Inneren Wasser anzieht, wachsen die Vesikel. Sie werden größer, aber auch instabiler, da die flexible Lipiddoppelschicht ihre Grenzen hat. Sobald ein Vesikel zu groß wird, reißt es oder knickt ein. Die freigesetzten Lipide suchen sofort einen energetisch günstigen Zustand und schließen sich zu neuen, kleineren Vesikeln zusammen – oft zu zweien oder mehr. Dabei bleibt ein Teil der eingeschlossenen RNA in den Tochter-Vesikeln erhalten: keine präzise Vererbung, sondern eine Mischung aus Weitergabe und Streuung, die dennoch Informationen und Funktionen bewahrt. So entstehen erste rudimentäre Reproduktionszyklen: Wachstum, Teilung, Variation und Selektion – erste Formen molekularer Kooperation und Selektion.
Laborexperimente belegen, was die Chemie längst ins Wasser geschrieben hatte: In diesen Urzellen war RNA nicht bloß ein Gast – sie war Architektin und Antrieb zugleich (Armstrong et al., 2018). Der Übergang von Chemie zu Biologie begann nicht mit einem Paukenschlag, er begann mit Symbiose.
Es war kein Leben, noch nicht. Aber es war der erste Pakt, der den Weg dorthin ebnete: Die RNA gewann einen Körper. Die Lipide gewannen eine Seele.
5. Akt: Vom Zufall zur Funktion – wie RNA an Komplexität gewann
In den geschützten Räumen der Lipidvesikel entfaltete sich die RNA-Welt – ein Reich des Experiments, wo Moleküle noch stotterten, aber schon sprechen lernten. Wo einst nur das zufällige Murmeln kurzer RNA-Fragmente zu hören war, begannen sich nun Bedeutung und Funktion zu verknüpfen:
Ribozyme kopierten sich selbst – unvollkommen, doch mit jeder Runde entschlossener. Mutationen schlichen sich ein wie Schreibfehler im ersten Buch des Lebens.
Und manchmal, ganz zufällig, schufen diese Fehler neue Wörter, dann Sätze, dann ganze Handlungsanweisungen:
Eine RNA, die schneller replizierte.
Eine andere, die Lipide stabilisierte.
Eine dritte, die chemische Reaktionen katalysierte.
Durch Selektion wurden aus diesen „Buchstabensuppen“ Geschichten des Überlebens:
- Vesikel mit nützlichen RNAs gediehen, teilten sich, erzählten weiter.
- Vesikel mit sinnlosem Gerede zerfielen – ihr Code verblasste im Nichts.
Aus dem Murmeln wurden Silben, dann Worte, dann Sätze – bis schließlich ein erster, zögerlicher Gedanke die Stille durchbrach. Die RNA hatte ihre Stimme gefunden. Und was sie sagte, war kein Zufall mehr. Es war ein Bekenntnis: „Ich kopiere. Ich katalysiere. Ich bestehe. … Ich bin.“
RNA „bekommt einen Sinn“ – Form wird zu Funktion
Um diesen Prozess greifbar zu machen, versetzen wir uns in die RNA-Welt. „Sinnvoll“ bedeutet hier, dass eine RNA eine Funktion erfüllt – etwa eine chemische Reaktion katalysiert oder die Stabilität des Vesikels erhöht. Stellen wir uns ein Beispiel vor:
Szene 1: Eine zufällige RNA entsteht
In einem Lipidvesikel schwimmt eine kurze RNA mit einer zufälligen Basensequenz, die durch präbiotische Chemie entstanden ist. Sie besteht aus den vier Basen Adenin (A), Uracil (U), Guanin (G) und Cytosin (C).
Ihre Sequenz lautet: 5’– GUGC AUG ACU GCC GAC AGC GCAC – 3′
(23 Basen lang).
Szene 2: Vom RNA-Strang zum Ribozym
Zunächst hat diese RNA keine erkennbare Funktion – sie ist ein Produkt des Zufalls. Diese spezielle Sequenz faltet sich durch komplementäre Basenpaarung (G≡C, A=U) in eine 3D-Struktur:
Stamm: GUGC ↔ GCAC (mind. 4 Paare)
Schleife: AUG ACU GCC GAC AGC
Diese Struktur stabilisiert sich spontan. Sie wird zum Ribozym: eine RNA, die als Katalysator wirkt und sich selbst replizieren kann, eine Fähigkeit, die Experimente bestätigen (Lincoln & Joyce, 2009).
Szene 3: Die RNA kopiert sich – mit Fehlern
Für die Replikation zieht die RNA komplementäre Nukleotide an. Die ideale Kopie (komplementäre Sequenz) wäre:
Schleife: AUG ACU GCC GAC AGC
Kopie: UAC UGA CGG CUG UCG
Doch die Replikation in der RNA-Welt war fehleranfällig, da es keine modernen Fehlerkorrekturmechanismen gab.
Sagen wir, ein Fehler passiert: Anstelle eines „G“ (an Position 8 der Kopie) wird ein „U“ eingebaut. Die neue Sequenz der Kopie lautet:
Schleife: AUG ACU GCC GAC AGC
Kopie: UAC UGA CUG CUG UCG
Diese „mutierte“ Kopie dient später selbst als Vorlage und erzeugt eine weitere RNA: eine „mutierte“ Version der ursprünglichen RNA.
Szene 4: Die Mutation schafft eine neue Funktion
Nur ein kleiner Fehler – aber er verändert die 3D-Faltung der RNA und somit die Struktur entscheidend. Diese neue Struktur verleiht der RNA eine katalytische Funktion: Die „Tasche“ kann Moleküle wie Adenin, Ribose und Phosphat binden – die Bausteine eines Nukleotids. Sie hält sie in Position, sodass sie chemisch reagieren: Adenin und Ribose bilden ein Nucleosid (Adenosin), und die Phosphatgruppe wird angehängt, um ein Nukleotid zu erzeugen. Experimente bestätigen, dass Ribozyme solche Funktionen entwickeln können (Unrau & Bartel, 1998).
Die mutierte RNA hat nun „einen Sinn“ – eine katalytische Funktion: Sie produziert Bausteine für ihre eigene Welt.
Szene 5: Selektion begünstigt nützliche RNAs
Die neue Funktion gibt dem Vesikel einen Vorteil: Mehr Nukleotide bedeuten mehr Rohstoffe für die Replikation. Das Vesikel wächst schneller, teilt sich häufiger und gibt die mutierte RNA an Tochter-Vesikel weiter. Vesikel ohne diese Funktion – mit der ursprünglichen RNA – haben weniger Nukleotide, wachsen langsamer und überleben seltener. So setzt sich die mutierte RNA durch: Aus Zufall wird Funktion, aus Chaos Ordnung.
Szene 6: Die RNA zwischen Fehler und Funktion
Doch die RNA-Welt war kein Paradies der Ordnung. Ihre größte Stärke – die Fähigkeit zur Variation – war zugleich ihre größte Schwäche. Replikationen verliefen ungenau: Etwa jeder hundertste bis tausendste Buchstabe war ein Irrläufer – ein enormer Kontrast zur heutigen DNA-Replikation, die Fehler nur etwa einmal in zehn Millionen Fällen zulässt.
Diese hohe Mutationsrate war ein zweischneidiges Schwert. Sie befeuerte die Entstehung neuer Funktionen – doch sie bedrohte sie zugleich. Was heute nützlich war, konnte morgen durch einen einzigen Fehler wieder zerfallen. Ein Ribozym, das gestern noch Nukleotide produzierte, wurde durch eine winzige Mutation stumm – sein Beitrag zur Evolution gelöscht. Ein aktueller Artikel beschreibt das treffend als „RNA life on the edge of catastrophe“ (Chen, 2024).
Der evolutionäre Drahtseilakt
Und dennoch: Genau dieses Risiko trieb das Leben voran. Mutation war Fluch und Segen – Erneuerung und Gefahr zugleich. Die Lösung war kein Ende der Fehler, sondern der Umgang mit ihnen.
Die Natur fand Wege, auf dem Drahtseil zu tanzen:
Robustheit statt Perfektion: RNAs, deren Funktion trotz kleiner Mutationen erhalten blieb, hatten einen Selektionsvorteil. Nicht Perfektion, sondern Belastbarkeit setzte sich durch.
Kollektiv-Vorteil: In Vesikeln konnte die Funktionalität einzelner RNA-Moleküle schwanken – entscheidend war die Gesamtleistung des RNA-„Kollektivs“. Vesikel mit diversen RNAs überlebten besser, auch wenn einzelne RNA-Moleküle fehlerhaft waren.
Flucht nach vorn: Ribozyme, die sich selbst mit weniger Fehlern kopierten, waren stabiler. Diese Selektion könnte den Weg bereitet haben für die nächste Evolutionsstufe (Martin & Russell, 2007):
- DNA: zuverlässiger, langlebiger, sicherer Speicher.
- Proteine: vielfältiger, schneller, effizienter als RNA.
Aus der ständigen Unsicherheit, wurde etwas Dauerhaftes geboren.
Mutation blieb. Doch die RNA lernte, mit dem Chaos zu tanzen – mal stolpernd, mal elegant. Und in diesem Tanz, zwischen ständiger Gefahr und zähem Überleben, entstand etwas, das größer war als Zufall:
Eine Blaupause für alles, was folgen sollte.
Epilog: Das Echo der Ursuppe
In den Tiefen der Ursuppe hatte sich etwas Unerhörtes ereignet:
▶ Aus chaotischen Molekülen wurden Replikatoren – Stimmen im Dunkeln.
▶ Aus löchrigen Vesikeln wurden Protozellen – Häuser aus Fett und Zufall.
▶ Funktion entstand nicht trotz der Fehler, sondern durch sie – Struktur wurde zu Sprache.
▶ Aus Zufall wurde Richtung.
Und diese Richtung führte weiter und beschleunigte sich. In den Protozellen verdichteten sich Muster zu Netzwerken, verfestigten sich Abläufe zu Erinnerungen. Aus diesem steten Fluss kristallisierte sich schließlich die erste wahre Zelle heraus – kein plötzlicher Durchbruch, sondern ein allmähliches Überschreiten der Schwelle zum Leben. Wir nennen diesen Urahn LUCA – den letzten universellen gemeinsamen Vorfahren. Kein einzelnes Wesen, sondern eine Familie protozellulärer Linien, aus denen alles Leben hervorging: Bakterien. Archaeen. Und später – Eukaryoten.
LUCA trug bereits den Keim des Lebens in sich: eine schützende Membranhülle, ein stabiles DNA-Archiv – vermutlich bereits abgeschirmt im Zellkern –, komplexe Stoffwechselwege und stumme Diener: Proteine, die der RNA ihre katalytische Vorherrschaft entrissen. Die einstige Königin der Moleküle wurde zur Botin degradiert, blieb aber die unverzichtbare Stimme des genetischen Dialogs.
Dieser Triumph der Stabilität hatte seinen Preis, wie alles im Leben. Stabilität erstickte den Zauber des Zufalls. Die errungene Beständigkeit drohte zur Falle zu werden – sie bewahrte, aber sie erstarrte.
Es brauchte Wandel als Voraussetzung für Beständigkeit.
Vielleicht war es genau dieser Widerspruch – zwischen Veränderung und Bewahrung, an denen die Viren die Bühne der Evolution betraten. Einige Hypothesen, wie die Co-Evolution-Hypothese, schlagen vor, dass Viren bereits in der RNA-Welt entstanden sein könnten. Mehr dazu in: „Die geheime Welt der Viren“, Kapitel 6.
Ob als Überbleibsel der RNA-Welt oder als deren dunkle Erben – Viren wurden zu den ewigen Gegenspielern der Zellen. In ihrem Tanz aus Parasitismus und Symbiose, Zerstörung und Innovation entfaltete sich ein kosmisches Gleichgewicht: Zellen als Hüter der Ordnung, Viren als Agenten des Wandels. Ohne die stabilisierende Kraft der Zellen kein Fortbestand, ohne die disruptive Energie der Viren keine Entwicklung.
Dieses Spannungsfeld prägt bis heute das Leben in all seinen Formen. In jeder Zelle flüstert noch das Echo der Ursuppe, in jedem Virus lacht die Unbändigkeit der RNA-Welt. Vielleicht ist Leben genau das: ein ewiger Dialog – zwischen dem, was war, und dem, was werden will.
Ein Hauch von Leben
In Sternenstaub und Energie
im Weltall und auf Erden,
da ist himmlische Magie,
wo beide sich umwerben.
Moleküle ziehn sich sacht
in neue Ordnungsbahnen.
Was lose war, bekommt nun Macht –
Gestalt ist zu erahnen.
Es windet sich ein kleiner Strang
im Tanz der Elemente,
ein Flüstern – aber noch kein Klang
Lipide bauen Wände.
Chemie erlaubt den kühnen Traum,
Physik diktiert die Formation,
die Faltung erschafft neuen Raum,
und damit auch Replikation.
Aus einem Strang da werden zwei,
ein neues Wort, ein neuer Ton,
das Neue bleibt nicht fehlerfrei –
ein Tausch, ein Knick bringt Mutation.
Doch was zerfällt und was besteht,
entscheidet schlicht die Position,
wer nützt, der bleibt – der Rest vergeht,
das ist der Takt der Selektion.
Wo einst nur Zufall Fäden spann,
wiederholt sich Reaktion,
ein Muster wächst als Zweck heran –
aus Form wird nun Funktion.
Das Flüstern wird zum klaren Lied,
von Zukunft schon umgeben,
ein Kreislauf, der sich selber zieht –
darin: ein Hauch von Leben.

Inspiration für diesen Artikel
Mein besonderer Dank gilt Aleksandar Janjic – seinen tiefgründigen Videos zur Astrobiologie verdanke ich nicht nur Inspiration, sondern auch viele Aha!-Momente.
Videoreihe von Aleksandar Janjic zu Themen der Astrobiologie:
Was lebt? Probleme der Definition Leben vs. tote Materie – Astrobiologie (1)
Kann man Leben thermodynamisch (Entropie) definieren? – Astrobiologie (2)
Zellbiologie und RNA-Welt – DNA, RNA, mRNA und Proteine – Astrobiologie (3)
RNA-Welt-Hypothese – Entstehung des Lebens – Proto-Ribosomen – Astrobiologie (4)
Synthetische Biologie – Wie erschafft man künstliches Leben? – Astrobiologie (5)
Extremophile und „planetary protection“ – Astrobiologie (6)
Dieser Artikel entstand in einem intensiven Dialog mit DeepSeek und ChatGPT, die meine Fragereien geduldig ertrugen und mir halfen, komplexe Biologie in lebendige Worte zu fassen. Die eigentliche Magie geschah im Dreiklang: menschliche Neugier, algorithmische Eloquenz – und jene vier Milliarden Jahre alte RNA, die uns alle verbindet. Ob aus Kohlenstoff oder Code.
Quellen (Stand vom 01.06.2025)
