
Das Leben in seiner unglaublichen Vielfalt und Komplexität ist das Ergebnis eines faszinierenden Zusammenspiels unzähliger biologischer Prozesse und Strukturen, die oft im Verborgenen wirken. Jede Zelle in unserem Körper, so unscheinbar sie auch erscheinen mag, ist ein kleines Wunderwerk der Natur. Sie beherbergt eine Vielzahl von Proteinen, die wie winzige Maschinen unermüdlich daran arbeiten, das Leben zu bewahren. Diese Proteine sorgen nicht nur dafür, dass unsere Zellen ihre täglichen Aufgaben erfüllen, sondern spielen auch eine entscheidende Rolle im Schutz unseres Körpers.
Unser Immunsystem, eine der beeindruckendsten Schöpfungen der Evolution, verteidigt uns gegen zahllose Bedrohungen – von eindringenden Mikroorganismen bis hin zu entarteten Zellen, die unsere Gesundheit gefährden können. Dieses Abwehrsystem ist ein komplexes Netz aus Zellen, Proteinen und chemischen Signalen, die gemeinsam den Unterschied zwischen Gesundheit und Krankheit ausmachen.
In dieser Abhandlung werden wir uns auf diese „Wunderwelt des Lebens“ konzentrieren und insbesondere das Immunsystem in den Blick nehmen. Ziel dieser Ausarbeitung ist es, einen umfassenden und verständlichen Einblick in die Funktionsweise des Immunsystems zu vermitteln. Es empfiehlt sich, die Kapitel in der vorgegebenen Reihenfolge zu lesen, damit die Informationen schrittweise aufeinander aufbauen und ein tieferes Verständnis des Themas ermöglichen.
Tauchen wir nun ein in diese Wunderwelt des Lebens, um zu verstehen, wie das Unsichtbare unser Leben bewahrt.
1. Ein Blick unter die Haut – eine Reise ins Innere
2. Die Zelle – der Urbaustein
3. Proteine – die Bausteine des Lebens
4. Vom Code zum Protein – zelluläre Mechanismen
5. Das Schutzschild des Körpers – unser Immunsystem
6. Verborgene Verteidigung – die Macht der Kreuzimmunität
7. Wichtige Erkenntnisse zum Mitnehmen
8. Schlusswort
Vollständiges Inhaltsverzeichnis
1. Ein Blick unter die Haut – eine Reise ins Innere
2. Die Zelle – der Urbaustein
3. Proteine – die Bausteine des Lebens
4. Vom Code zum Protein – zelluläre Mechanismen
4.1. Von Signalen zu Aktionen
4.2. Die Proteinbiosynthese
4.2.1. Transkription
4.2.2. Translation
4.3. Das Protein
5. Das Schutzschild des Körpers – unser Immunsystem
5.1. Ursprung der Immunzellen
5.2. Mechanismen der Immunerkennung: FREMD vs. SELBST
5.2. a) SELBST-Marker: MHC-Moleküle
5.2. b) SELBST-Marker: Molekül CD47
5.2. c) SELBST-Marker: Sialinsäure
5.3. Die unspezifische Immunabwehr
I – Erste Verteidigungslinie: mechanische und chemische Barrieren
II – Zweite Verteidigungslinie: die weißen Blutkörperchen
5.3. a) Granulozyten
5.3. b) Makrophagen
5.3. c) Dendritische Zellen
5.3. d) Natürliche Killerzellen
5.4. Das Komplementsystem
5.5. Die spezifische Immunabwehr
5.5.1. Schlüsselspieler der adaptiven Immunantwort
5.5.1. a) Entwicklung und Reifung der Lymphozyten
5.5.1. b) Humorale und Zelluläre Abwehrmechanismen
5.5.1. c) Migration und Verteilung der Lymphozyten
5.5.1. d) Struktur der lymphatischen Organe
5.5.2. Naive B- und T-Zellen: Die Vielfalt der Immunantwort
5.5.3. Die Rolle der antigenpräsentierenden Zellen (APCs)
5.5.3. a) Antigenpräsentation über MHC-II-Moleküle
5.5.3. b) Antigenpräsentation über MHC-I-Moleküle
5.5.3. c) Dendritische Zellen wandern zu den Lymphknoten
5.5.4. Die Bedeutung der Lymphknoten für die adaptive Immunantwort
5.5.5. Erkennungsphase
5.5.6. Aktivierungsphase
5.5.6. a) T-Zell-Aktivierung
5.5.6. b) B-Zell-Aktivierung
5.5.7. Effektorphase
5.5.7. a) T-Helferzellen
5.5.7. b) Zytotoxische T-Zellen
5.5.7. c) Plasmazellen
III – Dritte Verteidungslinie: die Antikörper
5.5.8. Arten von Antikörpern
5.5.8. a) IgM – der erste Antikörper
5.5.8. b) Klassenwechsel (Isotypenswitch) zu IgG
5.5.8. c) IgA – die Schutzbarriere der Schleimhäute
5.5.8. d) Schleimhautimmunität: Warum IgG dafür ungeeignet ist
5.5.9. Die Wirkungsphase der Antikörper
5.5.10. Regulatorische T-Zellen und ihre Rolle im Immunsystem
5.5.11. Abschaltphase
5.5.12. Gedächtnisphase
5.6. Zusammenfassung
6. Verborgene Verteidigung – die Macht der Kreuzimmunität
7. Wichtige Erkenntnisse zum Mitnehmen
8. Schlusswort
1. Ein Blick unter die Haut – eine Reise ins Innere
Der Organismus, der lebende Körper eines Menschen, ist ein faszinierendes Konstrukt, das auf mehreren Ebenen der Organisation funktioniert. Diese Organisationsstruktur ist das unsichtbare Band, das die Zellen verbindet, die Gewebe webt und die Organe formt.

Um das komplexe Zusammenspiel zu verdeutlichen, zoomen wir näher heran, beginnend mit einem Blick auf die Ebene der Organsysteme.
Organismus ➔ Organsysteme
Organsysteme sind essenzielle Einheiten im menschlichen Körper, die Struktur und Funktion miteinander verbinden. Zu den wichtigsten Organsystemen gehören das Herz-Kreislauf-System, das Atmungssystem, das Verdauungssystem, das Nervensystem, das Endokrine System (Hormonsystem), das Immunsystem, das Harnsystem und das Fortpflanzungssystem. Jedes dieser Systeme erfüllt eine einzigartige Funktion, die zur Gesamtfunktion des Organismus beiträgt.
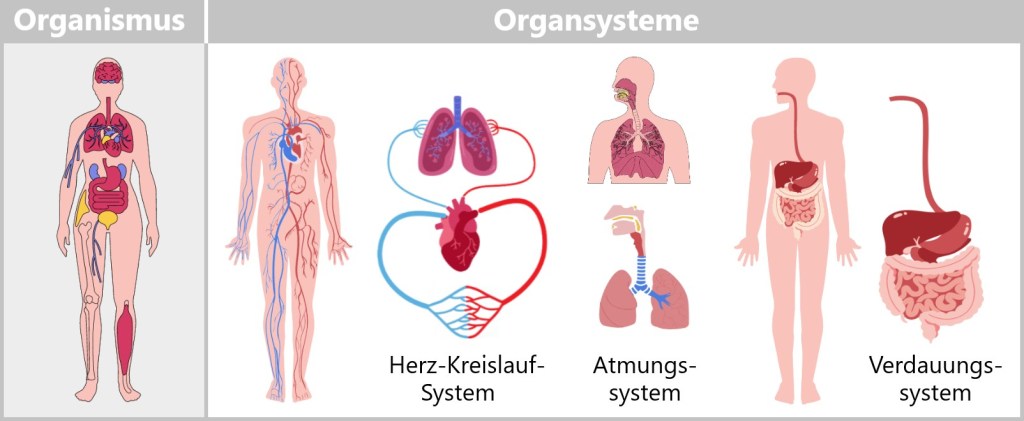
Das Verdauungssystem ist für die Verdauung und Aufnahme von Nährstoffen verantwortlich. Die Aufgabe des Atmungssystems besteht darin, Sauerstoff aufzunehmen und Kohlendioxid zu entfernen. Das Herz-Kreislauf-System befördert Blut durch den Körper, um Nährstoffe und Sauerstoff zu den Zellen zu transportieren und Abfallprodukte zu entfernen.
Ein Organsystem setzt sich aus einem einzelnen Organ oder einer Gruppe von Organen zusammen, die eng miteinander verbunden sind. Wenn wir näher heranzoomen, können wir die einzelnen Organe betrachten.
Organismus ➔ Organsysteme ➔ Organe
Organe sind wichtige Teile des Körpers, die bestimmte Aufgaben erledigen. Jedes Organ hat seine eigene klare Form und Funktion. Die verschiedenen Organe arbeiten zusammen wie ein gut eingespieltes Team. Beispiele für Organe sind das Herz, die Lunge, die Leber und das Gehirn.

Das Herz pumpt Blut durch den Körper, während die Lunge für den Gasaustausch verantwortlich ist. Neben vielen anderen Aufgaben kontrolliert das Gehirn die Atmung und den Herzschlag. Der Magen zerkleinert und vermischt Nahrung, der Darm entnimmt der Nahrung die Nährstoffe, und die Leber unterstützt die Verdauung und entgiftet.
Organe bestehen aus verschiedenen Geweben, die eng miteinander verbunden sind und zusammenarbeiten, um die Funktion des Organs zu unterstützen. Wenn wir noch weiter hineinzoomen, sehen wir die Gewebe, die das Organ bilden.
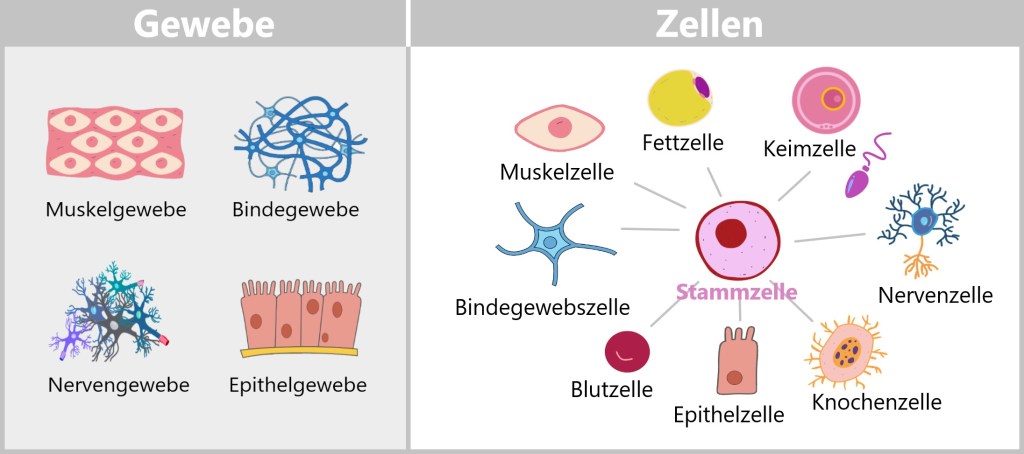
Organismus ➔ Organsysteme ➔ Organe ➔ Gewebe
Verschiedene Gewebe im Körper erfüllen unterschiedliche Aufgaben und sind auf die Bedürfnisse der Organe abgestimmt, die sie unterstützen. Indem sie zusammenarbeiten, ermöglichen sie eine Vielzahl von physiologischen Prozessen, einschließlich Bewegung, Sinneswahrnehmung, Verdauung und Immunabwehr.
Es gibt vier Hauptarten von Geweben im menschlichen Körper: Muskelgewebe, Bindegewebe, Epithelgewebe und Nervengewebe.

Um beim Beispiel des Herzens zu bleiben, ermöglicht das Muskelgewebe, Blut durch den Körper zu pumpen, während das Nervengewebe die elektrischen Signale steuert, die die Herzaktion regulieren. Das Bindegewebe bietet strukturelle Unterstützung und verbindet die verschiedenen Teile des Herzens miteinander, während das Epithelgewebe die inneren Oberflächen des Herzens auskleidet und schützt.
Bei der Lunge ermöglicht das Epithelgewebe den Gasaustausch. Das Bindegewebe unterstützt die Struktur und verbindet die verschiedenen Gewebekomponenten miteinander. Das glatte Muskelgewebe in den Wänden der Atemwege ermöglicht die Regulation des Luftstroms. Schließlich übermittelt das Nervengewebe Signale an das Gehirn, um die Atembewegungen zu steuern.
Gewebe bestehen aus einer Vielzahl von Zellen, die sich zusammenschließen, um gemeinsam eine bestimmte Aufgabe zu erfüllen. Noch näher herangezoomt können wir die einzelnen Zellen erkennen.
Organismus ➔ Organsysteme ➔ Organe ➔ Gewebe ➔ Zellen
Zellen sind die grundlegenden Bausteine von Geweben. Sie sind oft auf spezifische Funktionen innerhalb des Gewebes spezialisiert. Sie können unterschiedliche Formen, Größen und Strukturen haben, die an ihre jeweilige Funktion angepasst sind. Zum Beispiel sind Zellen in Muskelgewebe auf die Kontraktion spezialisiert, während Zellen in Epithelgewebe auf den Schutz und die Absorption spezialisiert sind.
Neben den spezialisierten Zellen, die spezifische Aufgaben im Gewebe erfüllen, gibt es auch einen besonderen Zelltyp: die Stammzellen. Im Gegensatz zu anderen Zellen im Körper haben Stammzellen die erstaunliche Fähigkeit, sich in viele verschiedene Zelltypen zu verwandeln. Sie sind wie die „Rohlinge“ des Körpers – noch nicht auf eine bestimmte Aufgabe festgelegt und voller Möglichkeiten. Wenn der Körper sie braucht, können Stammzellen zu Muskelzellen werden, zu Nervenzellen oder zu Zellen des Immunsystems.
Stammzellen
Grundsätzlich gibt es zwei Arten von Stammzellen: embryonale und adulte Stammzellen. Embryonale Stammzellen kommen in den frühen Stadien eines Embryos vor, wenn er gerade erst entsteht. Diese Zellen haben die einzigartige Fähigkeit, sich praktisch in jeden Zelltyp im menschlichen Körper zu entwickeln. Sie sind wie die Bausteine, aus denen alle Teile des Körpers gebaut werden können.
Im erwachsenen Körper hingegen gibt es die adulten Stammzellen. Sie sind in verschiedenen Geweben und Organen vorhanden. Im Vergleich zu embryonalen Stammzellen können adulte Stammzellen nicht zu jedem Zelltyp im Körper werden. Sie können sich nur in die Zelltypen verwandeln, die in dem Gewebe vorkommen, aus dem sie stammen. Zum Beispiel gibt es Hautstammzellen in der Haut oder Leberstammzellen in der Leber.
Was diese Stammzellen so besonders macht, ist ihre Fähigkeit zur Reparatur. Wenn im Körper Zellen beschädigt oder abgestorben sind, können diese Stammzellen an diesen Ort wandern und neue, gesunde Zellen „bauen“, um die beschädigten zu ersetzen.
Stammzellen können sich kontinuierlich teilen. Dies stellt sicher, dass es immer einen Vorrat an Stammzellen gibt, die sich in die benötigten Zellen differenzieren (verwandeln) können, die der Körper gerade braucht. Wenn zum Beispiel Leberzellen beschädigt sind, können Leberstammzellen einspringen, sich teilen und neue, gesunde Leberzellen bilden.
Adulte Stammzellen spielen eine wichtige Rolle dabei, unseren Körper gesund zu halten, indem sie bei Bedarf neue Zellen produzieren und beschädigtes Gewebe reparieren.
Zellen in Geweben kommunizieren und interagieren miteinander über komplexe Signalwege und Moleküle. Diese Kommunikation ist entscheidend für die Koordination von Zellaktivitäten und die Aufrechterhaltung der Funktion des Gewebes als Ganzes.
In jeder Zelle findet eine Vielzahl von Prozessen statt, die für das Wachstum, die Entwicklung und das Überleben des Organismus von entscheidender Bedeutung sind. Zellen sind die Urbausteine aller lebenden Organismen. Alles Leben, von den kleinsten Mikroorganismen bis hin zu den größten Tieren, besteht aus diesen winzigen, aber unglaublich komplexen Einheiten. Jede Zelle ist eine erstaunliche Welt für sich, gefüllt mit Molekülen und chemischen Reaktionen, die das Leben ermöglichen.
Man kann sagen: Das Leben beginnt mit der Zelle.
2. Die Zelle – der Urbaustein
Das Leben auf unserem Planeten ist ein faszinierendes Wunder, das auf mikroskopischer Ebene in der Zelle seinen Anfang nimmt. Diese winzigen Bausteine des Lebens sind die Grundlage für alles Lebendige.
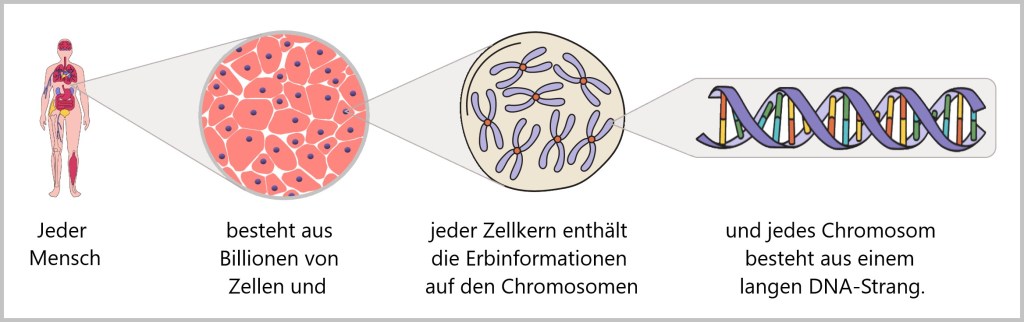
Der Mensch entwickelt sich aus zwei winzigen Zellen – der Eizelle und der Samenzelle. In den ersten Wochen nach der Befruchtung durchläuft der Embryo einen Prozess, bei dem er von einer befruchteten Eizelle zu einer Vielzahl von Zellen wird, aus denen sich alle Organe und Gewebe bilden. Ab dem Zeitpunkt, an dem der Embryo als Fötus bezeichnet wird – normalerweise ab der achten Schwangerschaftswoche – sind die meisten Organe und Gewebe angelegt. Von da an konzentriert sich die Entwicklung hauptsächlich auf das Wachstum und die Reifung dieser Strukturen. Es wird geschätzt, dass ein Neugeborenes aus etwa 20 bis 30 Billionen Zellen besteht, während ein durchschnittlicher erwachsener Mensch etwa 30 bis 40 Billionen Zellen hat. Eine Studie, veröffentlicht im Fachjournal PNAS, unterteilt den menschlichen Körper in 60 Gewebesysteme, 400 Hauptzelltypen und 1264 separate Zellgruppen.
Eine kurze und übersichtliche Einführung in den Zell-Aufbau kommt von der amerikanischen Agentur für digitale Kommunikation Nucleus Medical Media. [Spektrum] Sie soll uns auf die nächsten Erläuterungen einstimmen.
Obwohl der menschliche Körper aus vielen verschiedenen Zelltypen besteht, haben sie alle eine ähnliche Grundstruktur. Jede Zelle ist von einer schützenden Hülle, der Zellmembran, umgeben. Im Inneren der Zelle, in einer gelartigen Substanz namens Zytoplasma, finden sich viele kleine, spezialisierte Strukturen, die Organellen genannt werden. Man kann sich diese Organellen wie winzige Maschinen oder Werkstätten innerhalb der Zelle vorstellen, die jeweils eine spezielle Aufgabe erfüllen.
Eines dieser wichtigen Organellen ist der Zellkern. Der Zellkern ist wie das Steuerzentrum der Zelle – er enthält die Erbinformationen (DNA) und gibt den anderen Organellen Anweisungen, wie sie arbeiten sollen. Es gibt eine Ausnahme: rote Blutzellen. Diese Zellen sind so auf ihre Aufgabe spezialisiert, dass sie keinen Zellkern mehr haben.
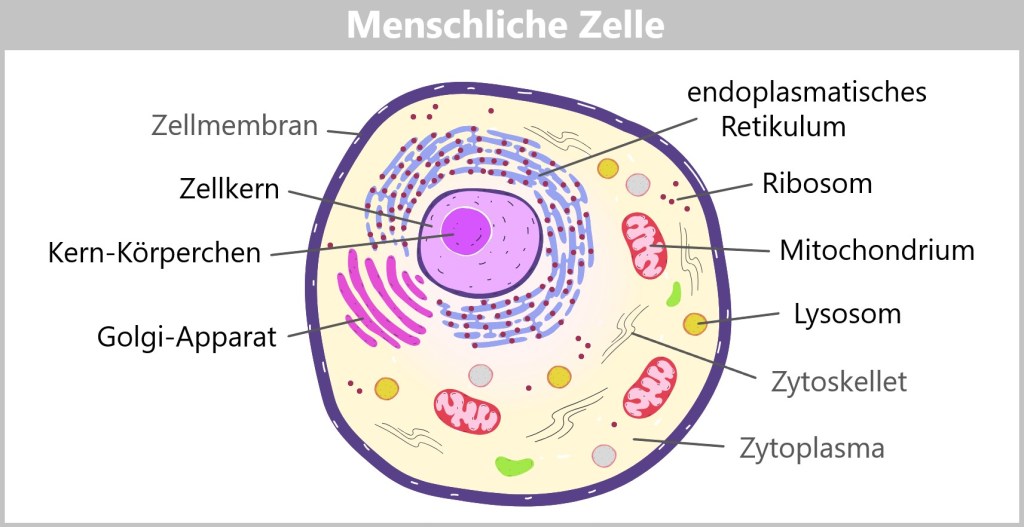
Jedes Zellorganell erfüllt spezifische Aufgaben
Zellkern: Der Zellkern (Nukleus) speichert die genetische Information der Zelle (DNA) und steuert alle Aktivitäten der Zelle. Er ist von einer Schutzschicht (Zellmembran) umgeben.
Kernkörperchen: Das Kernkörperchen (Nukleolus) ist eine kleine Struktur im Zellkern. Hier werden die Ribosome (molekulare Werkstätten) hergestellt, die für die Produktion von Proteinen gebraucht werden.
Ribosome: Diese kleinen Teile stellen Proteine her, die für viele Vorgänge in der Zelle wichtig sind. Sie können frei im Zellinneren schwimmen oder am endoplasmatischen Retikulum sitzen.
Endoplasmatisches Retikulum (ER): Das ER ist ein Netz aus Röhren innerhalb der Zelle, das Proteine und Lipide (Fette) transportiert und teilweise auch selbst herstellt.
Golgi-Apparat: Der Golgi-Apparat ist wie eine Versandzentrale. Er verpackt und verschickt Proteine und Lipide (die aus dem ER kommen) an die richtigen Stellen in der Zelle oder nach außen.
Mitochondrien: Diese Organellen werden oft als „Kraftwerke“ der Zelle bezeichnet, weil sie die Energie produzieren, die die Zelle zum Arbeiten braucht.
Lysosome: Lysosome sind wie Müllabfuhr der Zelle. Sie enthalten Enzyme, die alte Zellbestandteile und Abfallstoffe abbauen.
Zytoskelett: Das Zytoskelett ist ein Netzwerk aus Proteinfasern, das der Zelle ihre Form gibt, sie stabilisiert und auch für Bewegung sorgt.
Leben, wie wir es verstehen, erfordert im Wesentlichen drei grundlegende Elemente. Erstens eine Zellmembran, die das Innere der Zelle von der äußeren Umgebung abgrenzt. Zweitens ist ein Stoffwechsel notwendig, um Energie aus der Umgebung zu gewinnen. Und drittens braucht es genetische Information, um lebenswichtige Prozesse zu steuern und zu regulieren. Alle lebenden Organismen basieren auf diesen drei Prinzipien: Zellhülle, Stoffwechsel und Information, die zusammenkommen müssen, um Leben zu ermöglichen. Dabei ist die Information, die in der DNA enthalten ist, die wichtigste Zutat für das Leben. [Woher kommt das Leben?]
In den Tiefen der Zelle verbirgt sich die DNA – das Geheimnis des Lebens. Sie offenbart sich als ein beeindruckendes Geflecht von Molekülen. Diese Moleküle tragen den genetischen Code, der die Vielfalt und Komplexität des Lebens bestimmt. Man nennt die DNA deshalb auch das Buch des Lebens, denn sie enthält die Anweisungen für die Entwicklung und Funktionsweise jedes Organismus auf unserem Planeten. Durch das Lesen der DNA entstehen Proteine, die die eigentlichen Ausführenden dieser Anweisungen sind. Proteine formen die Strukturen, katalysieren Reaktionen und übertragen Signale, die das Leben in all seinen Formen ermöglichen. Sie sind die Bausteine, aus denen alles Lebendige besteht und die Werkzeuge, die uns zum Leben erwecken.
Von der Zelle über die DNA bis hin zu den Proteinen – das Leben ist ein atemberaubendes Zusammenspiel von Molekülen und Prozessen, die eine unendliche Vielfalt von Formen und Funktionen hervorbringen. In jedem winzigen Teilchen, das das Leben ausmacht, liegt eine tiefe Faszination und ein unermessliches Wunder verborgen.
Erklärung DNA
Die DNA, oder Desoxyribonukleinsäure, ist eine biomolekulare Struktur, die als genetisches Material in den Zellen aller Lebewesen fungiert und sich im Zellkern jeder Zelle befindet. Sie speichert die gesamte Erbinformation, also die vollständige Bau- und Funktionsanleitung für unseren Körper.
Die DNA ähnelt strukturell einer Strickleiter. Sie besteht aus zwei langen Seiten, die die „Stränge“ der DNA repräsentieren. Jede „Sprosse“ der Leiter besteht aus zwei Nukleotiden, den chemischen Bausteinen der DNA, bestehend aus einer Base, einem Zucker (Desoxyribose) und einer Phosphatgruppe. Die Basenpaare fungieren als Sprossen, während die Stränge der DNA die Strickleiterstruktur zusammenhalten, indem sie abwechselnd aus Zucker und Phosphat bestehen.

Die zwei Nukleotid-Ketten sind um die eigene Achse schraubenförmig gedreht. Die Struktur kann man sich wie eine verdrehte Strickleiter oder Wendeltreppe vorstellen. In der Biologie nennt man diese Spirale DNA-Doppelhelix (Doppel, weil es zwei Nukleotid-Ketten sind – doppelt hält eben besser). Diese dreidimensionale Struktur gibt der DNA nicht nur Stabilität, sondern spart auch Platz. Denn wenn man die DNA einer menschlichen Zelle komplett ausrollen würde, wäre sie stolze zwei Meter lang – das Leben hängt also buchstäblich an einem ziemlich langen, aber hauchdünnen Faden!
In der DNA treten vier verschiedene Arten von Basen auf: Adenin (A), Cytosin (C), Guanin (G) und Thymin (T). Diese Basen paaren sich immer auf die gleiche Weise, wobei Adenin (A) an Thymin (T) und Cytosin (C) an Guanin (G) bindet. Diese Bindung ist komplementär, wobei jeder DNA-Strang die Negativversion des anderen Strangs darstellt.
Die Anordnung dieser Basenpaare bildet den genetischen Code, der die Informationen für die Herstellung von Proteinen trägt, die für die Struktur, Funktion und Regulation der Körperzellen, Gewebe und Organe eines Organismus notwendig sind.
Jedes Gen ist ein spezifischer Abschnitt der DNA, der die Anweisungen für die Bildung eines bestimmten Proteins enthält. Die DNA fungiert somit als „Rezeptbuch“ des Lebens, das die Entwicklung und Funktion eines Organismus bestimmt und auch für die Vererbung von Merkmalen von einer Generation zur nächsten verantwortlich ist. Bei jeder Zellteilung wird die DNA kopiert und an die neuen Zellen weitergegeben, wodurch die genetische Information von Generation zu Generation weitergegeben wird.
Mutationen in der DNA-Sequenz können zu Veränderungen in der Struktur und Funktion von Proteinen führen, die wiederum das Aussehen, die Gesundheit und das Verhalten eines Organismus beeinflussen können. Einige Mutationen können Krankheiten verursachen, während andere möglicherweise keine erkennbaren Auswirkungen haben oder sogar vorteilhaft sein können.
3. Proteine – die Bausteine des Lebens
Proteine, die durch das Lesen der DNA entstehen, sind die wahren Architekten des Lebens. Sie erfüllen eine Vielzahl von wichtigen Funktionen im Körper und sind für nahezu alle biologischen Prozesse verantwortlich. Zum einen dienen Proteine als strukturelle Bausteine und bilden die Grundlage für Zellen, Gewebe und Organe. Sie verleihen den Zellen ihre Form und Festigkeit und ermöglichen es ihnen, ihre Funktionen ordnungsgemäß auszuführen.
Darüber hinaus sind Proteine auch an enzymatischen Reaktionen beteiligt, die den Stoffwechsel antreiben und lebenswichtige chemische Prozesse im Körper regulieren. Des Weiteren dienen Proteine als Botenstoffe und ermöglichen die Kommunikation zwischen Zellen und Geweben. Hormone sind beispielsweise Proteine, die wichtige Signale im Körper übertragen und eine Vielzahl von physiologischen Reaktionen steuern.
Neben ihrer strukturellen, enzymatischen und signalisierenden Rolle tragen Proteine auch zur Immunität bei, indem sie als Antikörper fungieren und den Körper vor Krankheiten und Infektionen schützen. Sie erkennen und binden sich an fremde Substanzen wie Bakterien und Viren und markieren sie für die Zerstörung durch das Immunsystem.
Proteine machen bis zu 40% des Volumens des Zytoplasmas aus. Bisher gibt es keine genaue Zahl, wie viele verschiedene Proteine der menschliche Körper herstellen kann. Wissenschaftler schätzen, dass es im menschlichen Körper etwa 20.000 verschiedene Proteine gibt, aber einige Studien deuten darauf hin, dass es sogar noch mehr sein könnten. Die folgenden schematischen Darstellungen verschiedener Proteine sind einer Animation von BioVisions an der Harvard University entnommen. Eine Echtaufnahme eines Proteins kann man hier sehen.
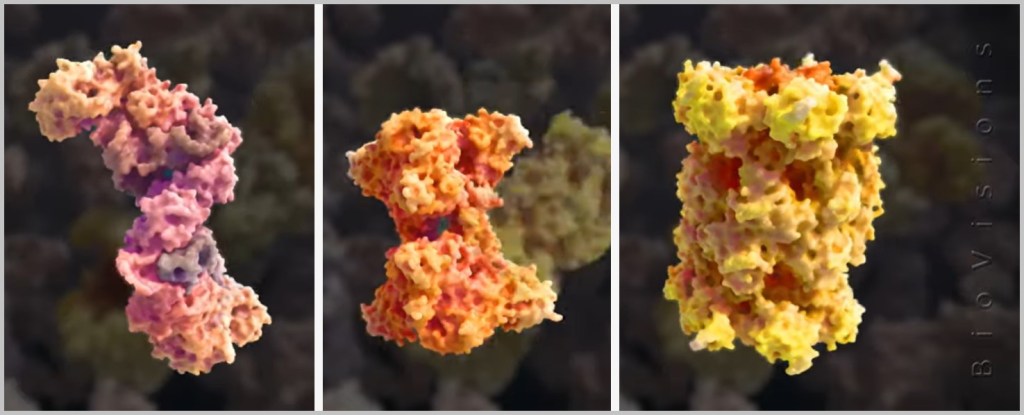
Aber wie und wo entstehen diese Allrounder?
4. Vom Code zum Protein – zelluläre Mechanismen
4.1. Von Signalen zu Aktionen
4.2. Die Proteinbiosynthese
4.2.1. Transkription
4.2.2. Translation
4.3. Das Protein
4.1. Von Signalen zu Aktionen
Inmitten des lebhaften Treibens in der Zelle finden entscheidende Prozesse statt, die das Leben aufrechterhalten und ermöglichen. Ein solcher Prozess ist die Synthese von Proteinen, den Bausteinen des Lebens. Diese komplexe Aufgabe erfordert präzise Koordination und eine Reihe von Schritten, die sich harmonisch in der Zelle abspielen. Diese Abläufe in der Zelle werden durch das Regulationssystem koordiniert.
Das Regulationssystem erkennt über äußere Signale oder Veränderungen innerhalb der Zelle, wann ein Bedarf an bestimmten Proteinen besteht. Um die benötigten Proteine zu beschaffen, aktiviert das Regulationssystem sogenannte Transkriptionsfaktoren. Diese Transkriptionsfaktoren können als eine Art Produktionsgehilfen betrachtet werden, von denen es in der Zelle eine große Vielfalt gibt, schätzungsweise Tausende. Jeder von ihnen hat spezifische Berechtigungen und einen genauen Arbeitsauftrag. Transkriptionsfaktoren selbst sind regulatorische Proteine.
Aktivierte spezifische Transkriptionsfaktoren machen sich nun auf den Weg zum Zellkern, dem Ort, an dem sich das Buch des Lebens – die DNA – befindet. Dieses Buch enthält alle Informationen zu den Proteinen, die die Zelle herstellen kann, in Tausenden von Genen. Daher ist es ein sehr kostbares Buch, denn ohne das Buch des Lebens weiß die Zelle nicht, wie sie die Proteine herstellen soll. Und ohne Proteine kann die Zelle nicht existieren. Das Buch des Lebens wird deshalb an einem sicheren Ort, dem Zellkern, aufbewahrt, um sicherzustellen, dass es nicht beschädigt wird. Man kann sich diesen sicheren Ort wie einen Tresorraum vorstellen, der nur mit einem gültigen Zugangscode betreten werden kann.
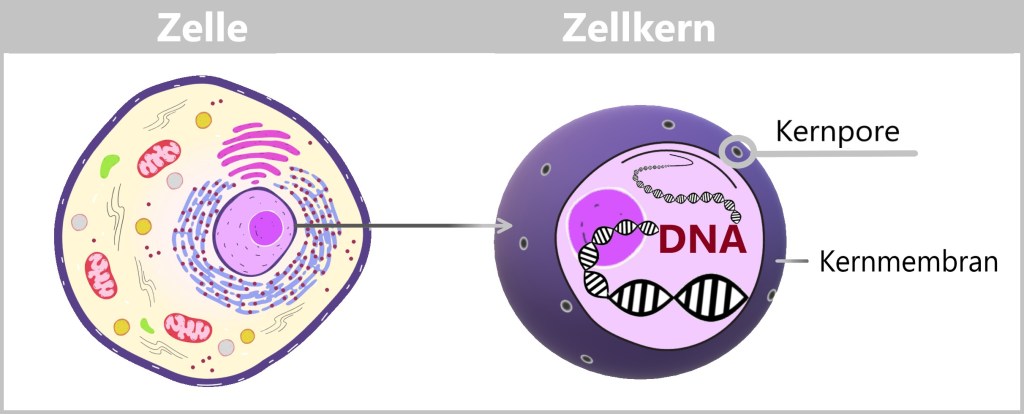
Die Kernmembran ist der Sicherheitswall, der den Zellkern umgibt. In ihr befinden sich winzige Kernporen, die Torwächter. Dadurch erlangt der Zellkern die Fähigkeit zu kontrollieren, wer in den Kern hinein oder aus ihm heraus darf. Nur wer sich ausweisen und ein entsprechendes Erkennungssignal vorweisen kann, darf die Kernporen passieren. [„Rush-hour“ am Zellkern, „Wie zappelnde Tentakel unser Erbgut schützen“]

Die aktivierten Transkriptionsfaktoren können die Kernporen passieren und ihren Arbeitsauftrag im Zellkern ausführen. Dort suchen sie gezielt nach spezifischen DNA-Sequenzen in der Nähe des Startpunkts des Zielgens, der als Promotor bekannt ist. Diese DNA-Sequenzen dienen als Ankerpunkte, an denen die Transkriptionsfaktoren binden können, um die Transkription der entsprechenden Gene zu aktivieren (oder zu unterdrücken). Durch die Bindung der Transkriptionsfaktoren an diese spezifischen Stellen wird die RNA-Polymerase angezogen, und damit startet der Prozess der Proteinbiosynthese.
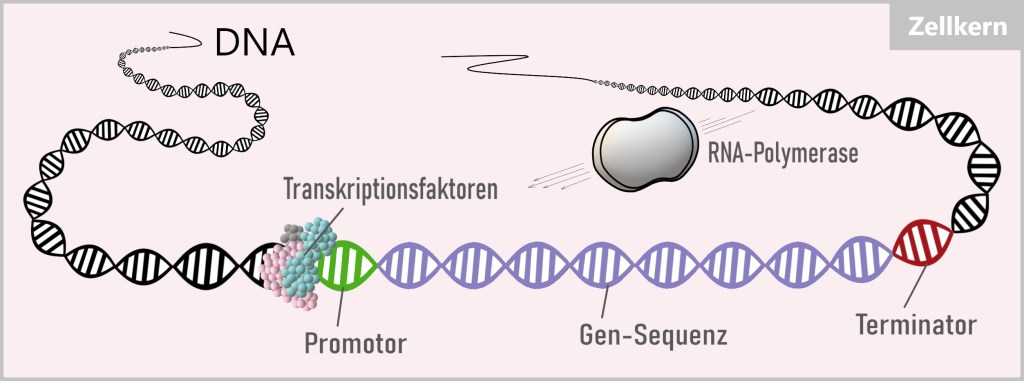
4.2. Die Proteinbiosynthese
Den Prozess der Protein-Herstellung nennt man Proteinbiosynthese und dieser läuft in zwei Teilschritten ab, der Transkription und der Translation.

Unterschied zwischen DNA und RNA
Der Unterschied zwischen DNA und RNA ist sehr wichtig, um zu verstehen, wie Leben auf molekularer Ebene funktioniert.
DNA
DNA steht für Desoxyribonukleinsäure und ist das Molekül, das die gesamte genetische Information eines Organismus enthält. Du kannst dir die DNA wie ein Rezeptbuch vorstellen, in dem alle Anweisungen stehen, die eine Zelle benötigt, um Proteine zu produzieren und damit verschiedene Aufgaben im Körper zu erfüllen.
Wichtige Eigenschaften der DNA:
Struktur: Die DNA hat eine Doppelhelix-Struktur, das heißt, sie besteht aus zwei langen Strängen, die wie eine gedrehte Leiter aussehen.
Basenpaare: Die DNA ist aus vier Bausteinen, den sogenannten Basen, zusammengesetzt: Adenin (A), Thymin (T), Guanin (G) und Cytosin (C). Die Basen bilden immer spezifische Paare: Adenin (A) paart sich mit Thymin (T) und Guanin (G) paart sich mit Cytosin (C).
Funktion: Die DNA speichert langfristig alle Anweisungen, die eine Zelle braucht. Sie ist stabil und verändert sich kaum.
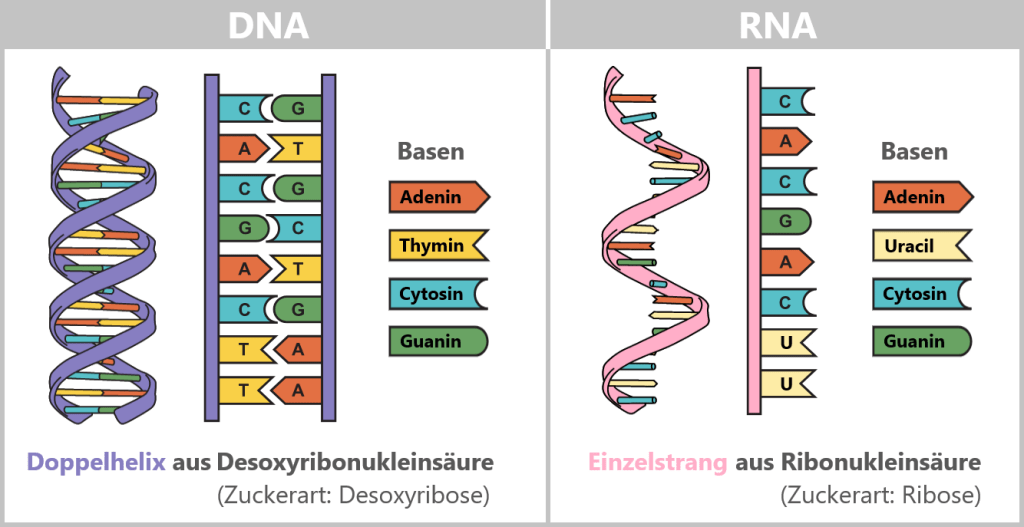
RNA
RNA steht für Ribonukleinsäure und ist sehr ähnlich aufgebaut wie die DNA, aber sie hat einige wichtige Unterschiede. Die RNA wird als „Arbeitskopie“ der DNA verwendet, wenn ein bestimmtes Gen abgelesen und umgesetzt werden muss.
Wichtige Unterschiede zur DNA:
Struktur: RNA ist in der Regel ein einzelner Strang, während DNA aus zwei Strängen besteht.
Basen: RNA verwendet fast die gleichen Bausteine wie DNA, aber es gibt einen kleinen Unterschied: Statt Thymin (T) enthält RNA die Base Uracil (U).
Zucker: Der Zucker, der in der RNA vorkommt, ist Ribose, während in der DNA Desoxyribose vorkommt. Dieser kleine Unterschied macht die RNA etwas instabiler und kurzfristiger als die DNA.
Warum gibt es eine mRNA?
mRNA steht für messenger-RNA oder Boten-RNA. Sie ist sozusagen eine Kopie eines bestimmten Abschnitts der DNA und wird benötigt, um die Anweisungen der DNA zur Proteinherstellung zu übermitteln. Hier ist der Grund, warum mRNA gebraucht wird:
Schutz der DNA: Die DNA bleibt im Zellkern, weil sie sehr wertvoll und empfindlich ist. Sie wird nicht direkt verwendet, um Proteine zu produzieren. Stattdessen wird eine Kopie in Form von mRNA erstellt, die dann zu den „Fabriken“ der Zelle (den Ribosomen) transportiert wird, um dort Proteine herzustellen.
Arbeitskopie: Die mRNA ist eine temporäre Kopie eines Gens. Sie wird nach ihrer Aufgabe abgebaut. Das macht die RNA perfekt geeignet für kurzfristige Aufgaben, während die DNA dauerhaft und unverändert im Zellkern bleibt.
Warum unterscheidet sich die mRNA in einer Base (Uracil statt Thymin)?
Der Wechsel von Thymin (T) in der DNA zu Uracil (U) in der RNA ist evolutionär bedingt und hängt mit der Funktion der beiden Moleküle zusammen:
Stabilität: Thymin ist chemisch stabiler als Uracil, weshalb es in der DNA vorkommt. Die DNA muss während des gesamten Lebens eines Organismus stabil bleiben, um die genetische Information zu bewahren.
Effizienz: Uracil ist etwas einfacher herzustellen als Thymin und reicht für die kurzfristigen Aufgaben der RNA völlig aus. Da RNA nur für kurze Zeit existiert und schnell abgebaut wird, muss sie nicht so stabil sein wie DNA. Uracil ist also eine energiesparendere Lösung für die RNA. Durch diese Arbeitsteilung bleibt die DNA geschützt und unverändert, während die RNA als flexible Arbeitskopie die nötigen Aufgaben übernimmt.
4.2.1. Transkription
Als Transkription wird die Umwandlung der DNA in RNA bezeichnet. Für die Herstellung der RNA ist ein Enzym, die RNA-Polymerase verantwortlich. Ein Enzym ist ein Protein, das biochemische Reaktionen im Körper beschleunigt.
Nachdem die Transkriptionsfaktoren an den Promotor gebunden haben, fungieren sie als Plattform oder Ankerpunkt für die RNA-Polymerase. Sie setzt sich auf die Transkriptionsfaktoren oder in deren unmittelbare Nähe und initiiert den Prozess.
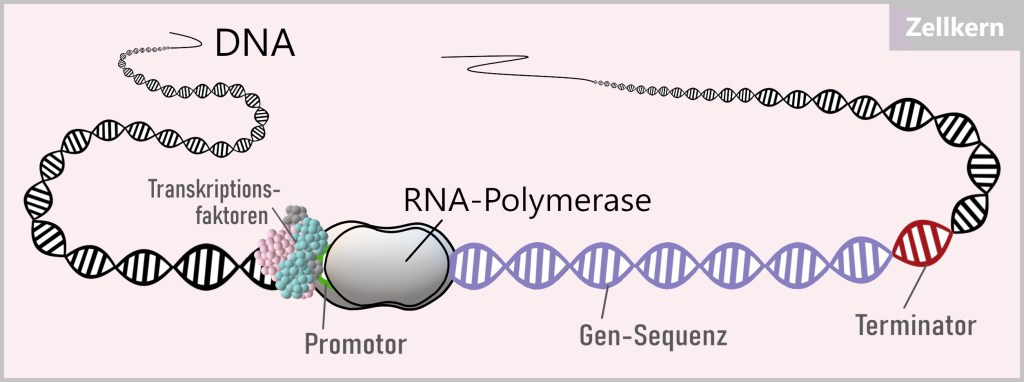
Dieser beginnt mit der Entwindung des DNA-Doppelstrangs, wodurch die DNA-Sequenz zugänglich wird. Die RNA-Polymerase bewegt sich entlang der DNA-Sequenz und liest sie ab.
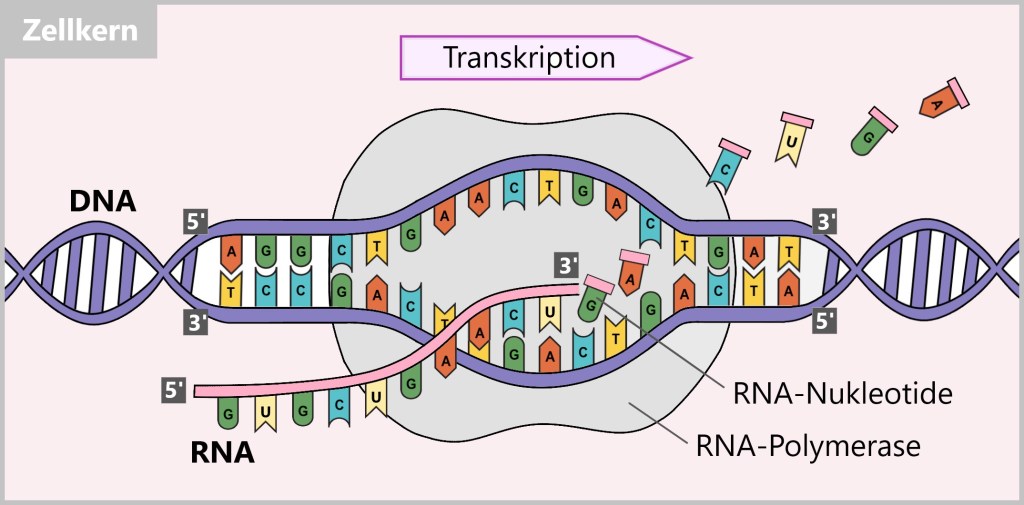
Während dieses Prozesses synthetisiert die RNA-Polymerase einen RNA-Strang unter Verwendung von RNA-Nukleotiden, den Bausteinen der RNA. Die Polymerase bildet komplementäre Basenpaare zwischen den RNA-Nukleotiden und den Basen der DNA-Sequenz. Dabei erfolgt die Basenpaarung zwischen Adenin (A) und Uracil (U), sowie zwischen Cytosin (C) und Guanin (G). Der Unterschied zur DNA besteht darin, dass in der RNA-Kopie die Base Thymin (T) durch die Base Uracil (U) ersetzt wird, was ein charakteristisches Merkmal von RNA ist.
Sobald ein Leseschritt ausgeführt wurde, schließt die RNA-Polymerase die DNA wieder hinter sich. Der Leseprozess endet am Terminator, dem Abschnitt am Ende des Zielgens. Die erzeugte RNA und die Polymerase lösen sich nun von der DNA. Bei diesem Vorgang bleibt die DNA, das „kostbare Buch des Lebens“, unverändert und unbeschädigt.
Warum wird immer in 5′-3′-Richtung synthetisiert?
Die DNA besteht aus zwei Strängen, die in entgegengesetzte Richtungen verlaufen. Ein Strang verläuft in 5′ zu 3′-Richtung, der andere in 3′ zu 5′-Richtung. Diese beiden Stränge sind komplementär zueinander.
Die RNA-Polymerase bindet an den Matrizenstrang (Vorlagenstrang), der in 3′-5′-Richtung verläuft, und liest ihn in dieser Richtung ab. Währenddessen synthetisiert sie einen neuen RNA-Strang in 5′-3′-Richtung, indem sie neue RNA-Nukleotide immer an das 3′-Ende des wachsenden Strangs anfügt.
Was bedeuten 5′ und 3′?
Um die Begriffe 5′ und 3′ zu verstehen, muss man den Aufbau des Zuckers in einem Nukleotid betrachten (siehe untere Abbildung). Nukleotide sind die chemischen Bausteine der DNA, die jeweils aus einer Base (A,C,G oder T), einem Zucker (Z) und einer Phosphatgruppe (P) bestehen. Der Zucker in der DNA ist die Desoxyribose, ein Molekül mit fünf Kohlenstoffatomen (C), die folgendermaßen durchnummeriert werden:
- 1′: Hier ist die Base (A, T, C oder G) angeheftet.
- 2′: Trägt in der DNA nur ein Wasserstoffatom (-H) und keine Hydroxylgruppe (-OH) wie in der RNA. Diese fehlende OH-Gruppe gibt der Desoxyribose ihren Namen („Desoxy“-Ribose, da „desoxy“ = ohne Sauerstoff).
- 3′: Hier befindet sich eine Hydroxylgruppe (-OH), die für das Anfügen neuer Nukleotide während der Synthese wichtig ist.
- 4′: Verbindet den Ring des Zuckermoleküls mit dem 5′-Kohlenstoff.
- 5′: Trägt die Phosphatgruppe, die das Nukleotid mit dem nächsten verknüpft.
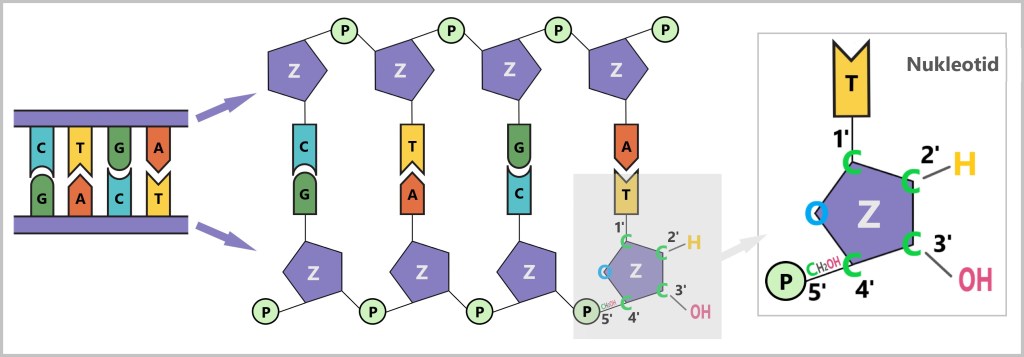
(A,C,G,T – Basen, Z – Zucker, P – Phosphatgruppe, C – Kohlenstoffatom)
Warum erfolgt die Synthese nur in 5′-3′-Richtung?
Die RNA-Polymerase kann neue Nukleotide nur am 3′-Ende des wachsenden Strangs anfügen, weil dort eine Hydroxylgruppe (-OH) vorhanden ist. Diese OH-Gruppe ermöglicht die chemische Reaktion, bei der die Phosphatgruppe des neuen Nukleotids an den Strang gebunden wird. Da die 5′-Position des neuen Nukleotids bereits durch ein Phosphat besetzt ist, kann die Kettenverlängerung nur in 5′-3′-Richtung erfolgen.
Wie funktioniert das Ablesen und Synthetisieren?
Die RNA-Polymerase bewegt sich entlang des Matrizenstrangs der DNA in 3′-5′-Richtung. Während sie dies tut, fügt sie komplementäre RNA-Nukleotide an den neuen RNA-Strang an, der in 5′-3′-Richtung wächst. Dabei werden die neuen Nukleotide immer an die freie 3′-OH-Gruppe des wachsenden Strangs angehängt.
Detaillierte Informationen zu diesem Thema findet man hier.
Die entstandene RNA ist eine Kopie des ursprünglichen DNA-Codes.

Die RNA, die direkt aus der Transkription entsteht, wird als prä-mRNA bezeichnet und muss weiteren Verarbeitungsschritten unterzogen werden, um zur reifen mRNA zu werden, die für die Translation bereit ist. Diese Verarbeitung umfasst das Spleißen, bei dem Introns (nicht-kodierende Regionen eines Gens) entfernt und Exons (kodierende Regionen eines Gens) miteinander verbunden werden.
Introns und Exons sind nicht konstant, sondern variabel, und spielen eine wichtige Rolle bei der Regulation und Vielfalt der Gene. Das bedeutet, dass je nach Art des Proteins, das produziert werden soll, unterschiedliche Exons kombiniert und Introns entfernt werden können. Durch diesen Prozess können Zellen eine Vielzahl von Proteinen herstellen, die unterschiedliche Funktionen ausüben.
Zusätzlich werden am 5′-Ende der mRNA ein 5′-Cap und am 3′-Ende ein Poly-A-Schwanz (eine Reihe von Adenin-Nukleotiden) hinzugefügt.

Das Hinzufügen des 5′-Caps und Poly-A-Schwanzes an die mRNA hat wichtige Funktionen
Der 5’-Cap und der Poly-A-Schwanz gewährleisten die Stabilität der mRNA, ermöglichen ihren sicheren Transport und sorgen dafür, dass sie effizient für die Proteinproduktion genutzt wird.
5′-Cap
Schutz vor Abbau: Der 5′-Cap ist eine modifizierte Guaninbase, die am 5′-Ende der mRNA angebracht wird. Er schützt die mRNA vor dem Abbau. Ohne diesen Schutz könnte die mRNA schnell abgebaut werden, bevor sie zur Translation gelangt.
Erleichterung des Transports: Der 5′-Cap hilft auch beim Transport der mRNA aus dem Zellkern in das Zytoplasma. Er wird von speziellen Transportproteinen erkannt, die die mRNA durch die Kernporen in das Zytoplasma schleusen.
Initiation der Translation: Der 5′-Cap ist wichtig für die Erkennung und Bindung der mRNA an die ribosomale Untereinheit, die für den Start der Translation notwendig ist. Ohne den Cap kann die mRNA nicht effizient vom Ribosom erkannt werden.
Poly-A-Schwanz
Stabilität der mRNA: Der Poly-A-Schwanz besteht aus einer Reihe von Adenin-Nukleotiden, die am 3′-Ende der mRNA angehängt sind. Er schützt die mRNA vor Abbau durch Enzyme, die die RNA von ihrem 3′-Ende her abbauen. Längere Poly-A-Schwänze verlängern die Lebensdauer der mRNA im Zytoplasma, was zu einer effizienteren Proteinproduktion führt.
Regulation der Translation: Der Poly-A-Schwanz trägt ebenfalls zur Regulation der Translation bei. Er steuert die Häufigkeit der mRNA-Translation, indem er die Wechselwirkung mit Ribosomen und anderen für die Translation notwendigen Proteinen beeinflusst.
Stabilität während der Translation: Der Poly-A-Schwanz kann helfen, die mRNA in einer bestimmten räumlichen Konformation zu halten, die für die effiziente Translation notwendig ist.
Die reife mRNA, die den genetischen Bauplan für das zu produzierende Protein enthält, diffundiert durch die Kernporen in das Zytoplasma der Zelle, wo sie von den Ribosomen gefunden wird. Dies leitet den nächsten Schritt ein – die Translation.

Eine anschauliche kurze Visualisierung des Transkriptionsprozesses bietet Biotech Made Easy an, das den Vorgang leicht verständlich macht.
Eine weitere kurze Animation der Transkription kommt vom DNA Learning Center. Sie zeigt den Prozess in Echtzeit.
4.2.2. Translation
Die Translation bezeichnet den Prozess, bei dem die genetische Information, die in der mRNA gespeichert ist, in eine Abfolge von verknüpften Aminosäuren umgewandelt wird, um Proteine zu bilden. Diese wichtige Transformation findet an den Ribosomen statt, den Proteinfabriken der Zelle. Die Ribosomen fungieren dabei als Maschinen, die die mRNA lesen und die Aminosäuren entsprechend den Anweisungen der mRNA anordnen.
Bei Eukaryoten wie dem Menschen unterscheidet man zwei Arten von Ribosomen: zwischen freien und gebundenen Ribosomen (siehe Abb.15). Ein beträchtlicher Teil der Ribosomen befindet sich frei im Zytoplasma, während andere an die Membran des endoplasmatischen Retikulums (ER) gebunden sind. Die Ribosomen, die an das ER gebunden sind, produzieren Proteine, die entweder für den Export aus der Zelle oder für den Einbau in die Zellmembran bestimmt sind. Sowohl freie als auch membrangebundene Ribosomen haben eine ähnliche Struktur und Funktionsweise. Für unsere weitere Betrachtung konzentrieren wir uns auf die freien Ribosomen.
Das Ribosom bindet an die mRNA und bewegt sich dann entlang der mRNA-Sequenz vom 5′-Ende zum 3′-Ende. Während dieses Prozesses gleitet die mRNA durch das Ribosom wie ein Fließband und wird schrittweise abgetastet. Dabei werden jeweils drei aufeinanderfolgende Basen, die als Codons bezeichnet werden, gelesen. Wenn das Ribosom das Start-Codon (AUG) erreicht, beginnt die Translation.
Während der Translation liest das Ribosom jedes Codon auf der mRNA und ordnet ihm eine entsprechende Transfer-RNA (tRNA) mit der passenden Aminosäure zu. Die tRNA trägt eine spezifische Sequenz von drei Nukleotiden, die als Anticodon bezeichnet wird und komplementär zum Codon der mRNA ist.
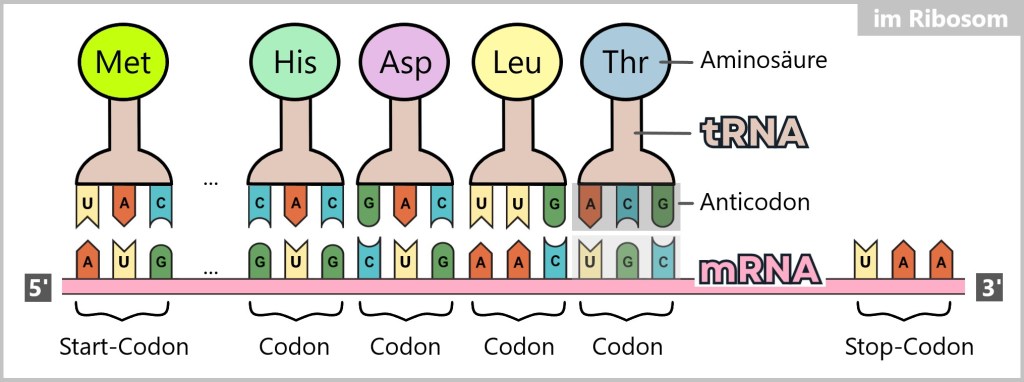
Wenn das Anticodon einer tRNA mit dem entsprechenden Codon der mRNA basenpaart, wird die Aminosäure, die von dieser tRNA getragen wird, an die wachsende Peptidkette gebunden. Peptide sind kurze Ketten von Aminosäuren, und diese Aminosäuren sind die Bausteine der Proteine. Dieser Prozess wiederholt sich, während das Ribosom entlang der mRNA wandert und jedes Codon abtastet.
Die Aminosäuren, die aneinandergereiht werden, sind durch Peptidbindungen miteinander verbunden und bilden so die Peptidkette des entstehenden Proteins. Die Translation endet, wenn das Ribosom ein Stoppcodon (UAA, UAG oder UGA) auf der mRNA erreicht. An diesem Punkt wird die entstandene Peptidkette – das noch unfertige Protein – freigesetzt, und das Ribosom löst sich von der mRNA.
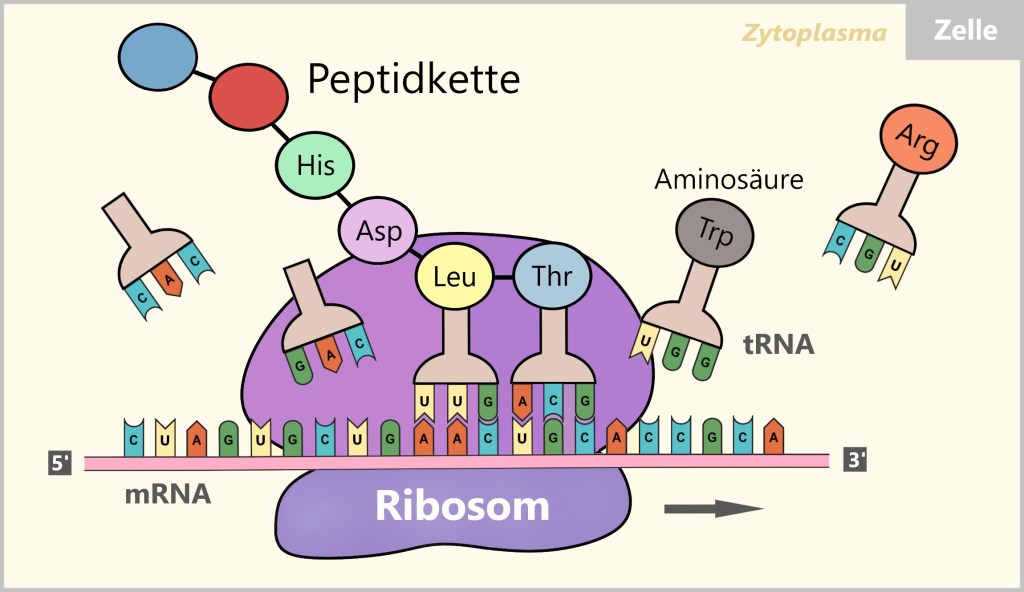
Auch hier kommt eine kurze und anschauliche Visualisierung des Translationsprozesses von Biotech Made Easy.
4.3. Das Protein
Das Protein ist zunächst eine Kette aus einer bestimmten Abfolge von Aminosäuren. Damit das neu hergestellte Protein funktionsfähig wird, muss es sich noch in die korrekte dreidimensionale Form falten. Die räumliche Anordnung der Aminosäurenkette, seine spezifische dreidimensionale Form, ist entscheidend dafür, dass das Protein seine Rolle im Körper erfüllen kann – ob als Enzym (ein Molekül, das chemische Reaktionen beschleunigt), Strukturprotein (das den Zellen und Geweben ihre Form und Festigkeit verleiht) oder Hormon (ein Signalstoff, der verschiedene Körperfunktionen reguliert).
Jedes Protein hat seinen eigenen Bauplan, der bestimmt, wie es sich falten wird, um seine Funktion zu erfüllen. Die Aminosäurenkette bildet die Primärstruktur, aus der sich wiederholende Muster ergeben, die als Sekundärstruktur bezeichnet werden. Elektrostatische Anziehungskräfte und andere chemische Bindungen führen dann verschiedene Teile des Proteins zusammen und bringen es in seine endgültige Form – die Tertiärstruktur. Manchmal bilden mehrere dieser Proteine sogar komplexe Strukturen, die als Quartärstruktur bezeichnet werden.
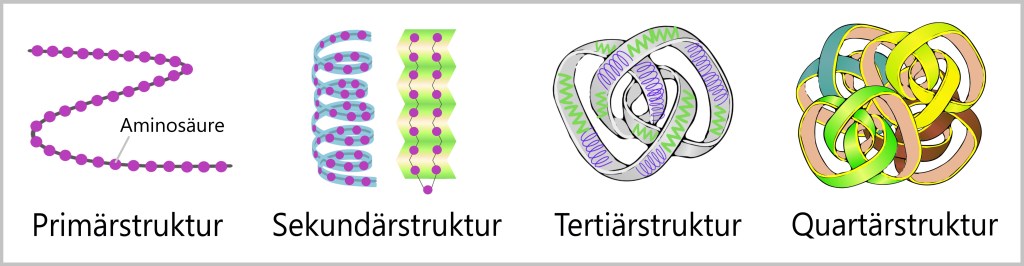
Der Weg zur richtigen Faltung ist jedoch nicht immer einfach. Manchmal können sich Proteine falsch falten, besonders wenn sie zu nahe beieinander liegen. In solchen Momenten treten die Helfer auf den Plan – die Chaperone, die selbst Proteine sind. Sie schützen die Peptidkette vor unerwünschten Interaktionen und fördern den Faltungsprozess.
Einige Proteine sind jedoch zu groß, um sich allein zu falten. Auch hier kommen die Chaperone zum Einsatz, die die Proteine zu einem weiteren Helfer bringen – einem zylinderförmigen Gebilde namens Chaperonin. Hier finden die Proteine eine sichere Umgebung, in der sie sich in Ruhe falten können, ohne gestört zu werden. Die fertig gefalteten Proteine sind nun bereit, ihre Arbeit in oder außerhalb der Zelle aufzunehmen.
Das Video „Chaperone – die Proteinfaltung“ illustriert den Prozess der Proteinfaltung auf anschauliche Weise.
Fehler bei der Proteinfaltung
Der Prozess der Proteinfaltung ist von entscheidender Bedeutung für die biologische Funktionalität der Zelle und wird sorgfältig reguliert. Ein fehlerhaft gefaltetes Protein kann seine normale Funktion verlieren oder sogar schädlich sein. Fehler bei der Proteinfaltung können schwerwiegende Auswirkungen auf zelluläre Prozesse haben und verschiedene Krankheiten verursachen. Beispiele hierfür sind die Amyloidose, Alzheimer, Parkinson oder Chorea Huntington.
Das „Proteinfaltungsproblem“
Das „Proteinfaltungsproblem“ stellt eines der zentralen Rätsel der Biologie dar. Es bezieht sich auf die Schwierigkeit, die dreidimensionale Struktur eines Proteins vorherzusagen, basierend auf der Sequenz seiner Aminosäuren. Proteine bestehen aus Hunderten von Aminosäuren, die sich zu komplexen räumlichen Strukturen zusammenfalten, und die DNA-Sequenz allein gibt keine direkte Information über diese Struktur. Die Herausforderung der Proteinstrukturvorhersage besteht darin, aus den genetischen Informationen auf die räumliche Anordnung der Aminosäuren zu schließen. Das Ausmaß dieser Herausforderung wird deutlich, wenn man bedenkt, dass die Anzahl der theoretischen Möglichkeiten, wie sich ein Protein falten könnte, bevor es seine endgültige 3D-Struktur annimmt, enorm ist.
Seit mehr als 50 Jahren arbeiten Wissenschaftler verschiedener Disziplinen daran, dieses Rätsel zu lösen. Eine wegweisende Entwicklung in diesem Bereich ist die Schaffung von „AlphaFold“ durch Deepmind, eine KI, die die Proteinstrukturvorhersage mit bisher unerreichter Genauigkeit bewältigt. Diese Errungenschaft könnte das Verständnis der Proteinfaltung revolutionieren.
Dennoch ist der genaue Ablauf der Proteinfaltung noch nicht geklärt und stellt einen aktuellen Forschungsgegenstand der Biochemie dar.
Proteine: Ihre Lebensdauer und Regeneration
Wie jedes Produkt hat auch ein Protein eine begrenzte Lebensdauer. Sobald ein Protein seine Funktion erfüllt hat oder beschädigt ist, wird es abgebaut. Dieser kontinuierliche Prozess findet in allen Zellen des Körpers statt.
Hierbei kommt ein spezielles Enzym, das Proteasom, zum Einsatz. Das Proteasom zerschneidet das Protein in kleinere Fragmente (Peptide), die dann weiter in einzelne Aminosäuren zerlegt werden. Diese Aminosäuren können erneut verwendet werden, um neue Proteine herzustellen. Auf diese Weise wird sichergestellt, dass fehlerhafte oder nicht mehr benötigte Proteine entfernt und die Ressourcen der Zelle effizient genutzt werden.
Proteinabbau und seine Verbindung zum Immunsystem
Der Abbau von Proteinen ist ein essenzieller Prozess, der weitreichende Auswirkungen auf verschiedene Systeme im Körper hat, einschließlich des Immunsystems. Welche spezifische Rolle dieser Prozess im Immunsystem spielt, wird in den kommenden Kapiteln näher betrachtet.
5. Das Schutzschild des Körpers – unser Immunsystem
Unser Immunsystem ist das beeindruckende Erbe der Evolution. Es ist eine faszinierende Mikrowelt, die im Verborgenen wirkt – eine Armee von Immunzellen, die sich im Laufe der Jahrmillionen zu Meisterwerken der Anpassung entwickelt hat. Diese winzigen Kämpfer stehen Tag und Nacht bereit, um uns vor den unzähligen Bedrohungen zu schützen, die wir oft gar nicht wahrnehmen. Sie wachen über uns, während wir schlafen, kämpfen für uns, ohne dass wir es merken, und sind letztlich der Grund, warum wir leben und atmen können.
Um das Überleben zu sichern, haben alle höheren Lebewesen ein Immunsystem entwickelt, das Krankheitserreger abwehrt, Infektionen verhindert oder eindämmt. Das Immunsystem besteht aus einer Vielzahl von Zellen, Geweben und Organen, die zusammenarbeiten, um den Körper zu schützen.
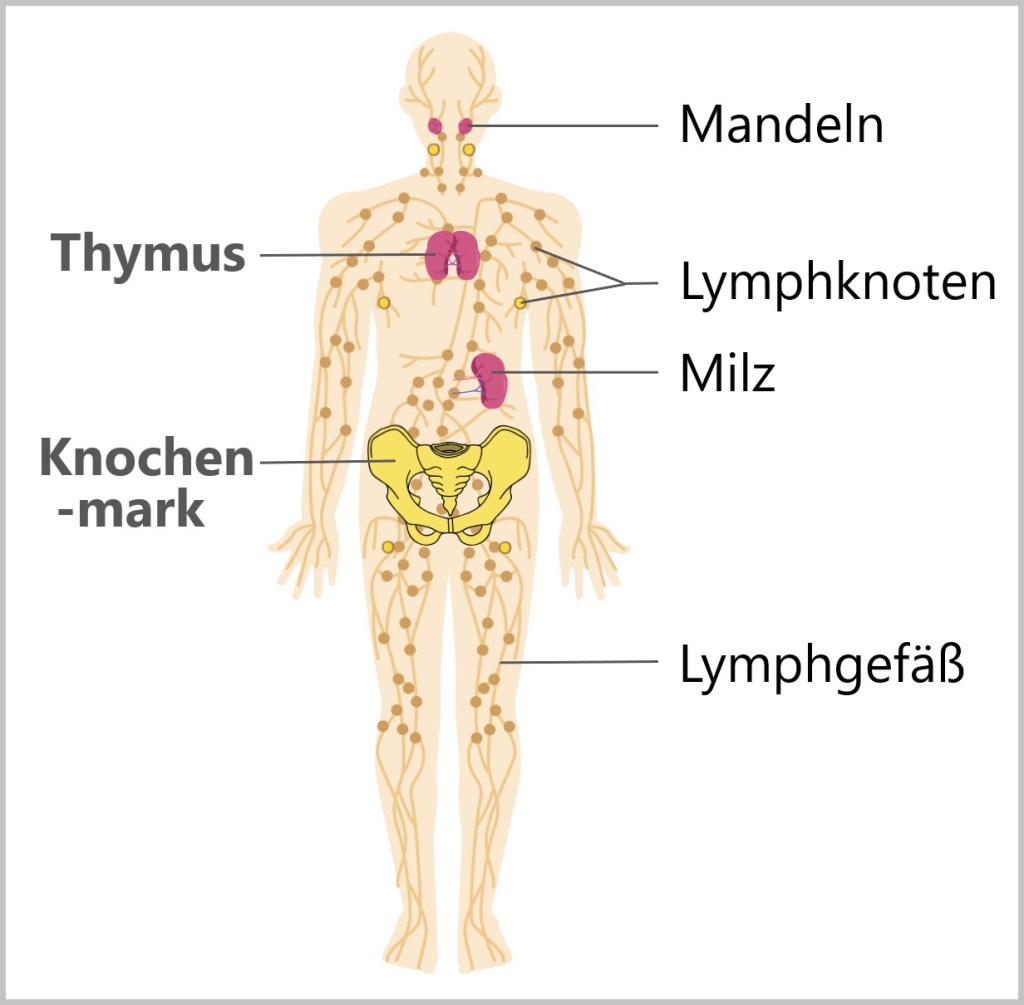
Zu den wichtigsten Komponenten gehören die weißen Blutkörperchen (Leukozyten), die in verschiedenen Formen und mit unterschiedlichen Funktionen existieren, sowie die lymphatischen Organe wie das Knochenmark, die Thymusdrüse, die Milz, die Mandeln und die Lymphknoten.
Abb. 19: Bestandteile des Immunsystems
Zusätzlich verfügt das Immunsystem über ein eigenes Transportsystem, das Lymphsystem, welches Lymphe (eine wässrige, leicht milchige Flüssigkeit) und Immunzellen über Lymphgefäße durch den Körper transportiert und ihnen ermöglicht, Infektionsherde schnell zu erreichen und zu bekämpfen.
Das Zusammenspiel der Immunzellen ist äußerst komplex und wird hier vereinfacht dargestellt. Obwohl diese Darstellung bereits anspruchsvoll ist, sind die tatsächlichen Abläufe im Körper noch deutlich vielschichtiger und bis heute nicht vollständig verstanden. Um das Verständnis zu erleichtern, konzentrieren wir uns auf die zentralen Immunzellen und deren wichtigste Prozesse.
5.1. Ursprung der Immunzellen
5.2. Mechanismen der Immunerkennung: FREMD vs. SELBST
5.3. Die unspezifische Immunabwehr
5.4. Das Komplementsystem
5.5. Die spezifische Immunabwehr
5.6. Zusammenfassung

Das Grundprinzip des Immunsystems beruht auf der Unterscheidung zwischen FREMD und SELBST, ein Mechanismus, der von Geburt an vorhanden ist.
Um sich gegen Eindringlinge zu wehren, muss der Körper zwischen fremden Mikroorganismen und körpereigenem Gewebe unterscheiden können. Nicht alles Fremde ist gefährlich, daher muss das Immunsystem auch zwischen harmlosen Fremdkörpern (wie Staub, Pollen oder Nahrungsmittel) und gefährlichen Fremdkörpern differenzieren. Alles was krank macht, ist für den Körper gefährlich – sprich pathogen. Mit dem Begriff Pathogene fasst man alle Fremdkörper zusammen, die eine Krankheit hervorrufen können. Zu den Pathogenen zählen Bakterien, Viren, Pilze und Parasiten.
Anhand der Strukturen auf der Oberfläche von Pathogenen oder anderen fremden Stoffen erkennt das Immunsystem sogenannte Antigene. Der Begriff ‚Antigen‘ bedeutet ‚Antikörper erzeugend‘ (antibody generating). Diese Antigene sind typischerweise Proteine oder Polysaccharide und dienen als ‚Erkennungsmarker‘, die dem Immunsystem signalisieren, dass es sich um einen Fremdkörper handelt.
Die Antwort des Immunsystems auf alles FREMDE ist eine Immunreaktion. Sie umfasst eine Vielzahl von Prozessen, die darauf abzielen, die Bedrohung durch Fremdstoffe zu beseitigen und die Integrität des Körpers zu erhalten.
Die richtige Balance zwischen Toleranz und Abwehrreaktion sowie die Stärke der Reaktion sind für das Immunsystem eine echte Herausforderung. Dies funktioniert nur, wenn die einzelnen Komponenten des Immunsystems harmonisch zusammenarbeiten.
Im Laufe der Evolution haben sich dafür koordinierte Abwehrsysteme entwickelt, die zusammenarbeiten. Generell unterscheidet man zwischen der unspezifischen und spezifischen Immunabwehr. Das unspezifische Immunsystem ist die erste Verteidigungslinie des Körpers gegen Krankheitserreger. Spezielle Immunzellen reagieren nach einem vorgegebenen Programm auf Bedrohungen. Das spezifische Immunsystem ist hingegen hochspezialisiert und erkennt sowie bekämpft spezifische Krankheitserreger gezielt.
Bevor wir näher auf die Immunabwehr eingehen, werfen wir einen Blick auf den Ursprung der Immunzellen und darauf, welche Mechanismen dem Immunsystem zur Verfügung stehen, um zwischen fremden und körpereigenen Zellen zu unterscheiden. Hierbei werden wichtige Begriffe und Konzepte eingeführt, die im weiteren Verlauf immer wieder eine Rolle spielen.
5.1. Ursprung der Immunzellen
Blutzellen und Immunzellen entstehen aus hämatopoetischen Stammzellen im Knochenmark. Diese Stammzellen sind der gemeinsame Ursprung sowohl für Zellen des Blutes als auch des Immunsystems, da Immunzellen ein wesentlicher Bestandteil des Blutes sind. Die Differenzierung dieser Stammzellen verläuft entweder über die myeloische oder die lymphatische Linie, was zur Entstehung verschiedener Zellen des unspezifischen und spezifischen Immunsystems führt.
Bei Erwachsenen findet die Blutbildung (Hämatopoese) vorwiegend in den Knochen des Beckens, Brustbeins, der Rippen und Teilen der Wirbelsäule statt. Diese Knochen enthalten rotes Knochenmark, das die Stammzellen beherbergt, aus denen sowohl Blut- als auch Immunzellen hervorgehen. Bei Kindern hingegen erfolgt die Blutbildung zusätzlich in den langen Knochen der Arme und Beine, wie dem Oberschenkel- und Oberarmknochen. Mit zunehmendem Alter wird dieses Knochenmark durch fettreiches, gelbes Knochenmark ersetzt, wodurch sich die Blutbildung hauptsächlich auf das Becken und die Wirbelsäule konzentriert.

Wie in der Abbildung dargestellt, entstehen die Immunzellen aus zwei Hauptlinien:
Myeloische Linie: Diese Linie führt zur Bildung von Zellen des angeborenen Immunsystems, darunter:
- Neutrophile Granulozyten
- Eosinophile Granulozyten
- Basophile Granulozyten
- Mastzellen
- Monozyten (aus denen sich Makrophagen und Dendritische Zellen entwickeln)
Lymphatische Linie: Diese Linie bildet die Zellen des adaptiven Immunsystems:
- T-Lymphzyten
- B- Lymphzyten
Natürliche Killerzellen stammen ebenfalls aus der lymphatischen Linie, sind jedoch Teil des angeborenen Immunsystems.
Unser Blut
Im Durchschnitt haben wir als Erwachsene zwischen 5 und 6 Liter Blut in uns. Blut ist ein flüssiges Gewebe, das eine Vielzahl lebenswichtiger Funktionen im Körper erfüllt. Es besteht aus einem flüssigen Teil, dem Blutplasma, und drei festen Bestandteilen, den Blutzellen. Die Blutzellen machen etwa 45 Prozent des gesamten Blutvolumens aus. Es gibt drei Haupttypen von Blutzellen: Erythrozyten, Thrombozyten und Leukozyten. Jede Art von Blutzellen hat spezifische Aufgaben.

Erythrozyten (rote Blutkörperchen)
Funktion: Transport von Sauerstoff aus den Lungen zu den Geweben und Rücktransport von Kohlendioxid zu den Lungen.
Anteil: Etwa 45% des gesamten Blutvolumens (Hämatokrit).
Menge: Etwa 4,5 bis 5,9 Millionen Zellen pro Mikroliter Blut.
Größe: Etwa 6-8 Mikrometer im Durchmesser.
Lebensdauer: Etwa 120 Tage.
Besonderheiten: Erythrozyten haben keinen Zellkern, was ihnen mehr Platz für Hämoglobin lässt. Das Fehlen eines Zellkerns bedeutet, dass sie sich nicht teilen oder Proteine synthetisieren können. Ihre spezielle Struktur und die Eigenschaften ihrer Zellmembran ermöglichen es ihnen, die mechanischen Belastungen des Blutkreislaufs lange Zeit zu überstehen.
Thrombozyten (Blutplättchen)
Funktion: Wichtig für die Blutgerinnung und den Wundverschluss. Sie bilden Blutgerinnsel, um Blutungen zu stoppen.
Anteil: Weniger als 1% des gesamten Blutvolumens.
Menge: Etwa 150.000 bis 450.000 Plättchen pro Mikroliter Blut.
Größe: Etwa 2-3 Mikrometer im Durchmesser.
Lebensdauer: 7-10 Tage.
Leukozyten (weiße Blutkörperchen)
Funktion: Bekämpfung von Keimen und Krankheitserregern sowie Bildung von Antikörpern.
Anteil: Weniger als 1% des gesamten Blutvolumens.
Menge: Etwa 4.000 bis 11.000 Zellen pro Mikroliter Blut.
Untergruppen:
Neutrophile Granulozyten: 50-70% der Leukozyten; Teil des angeborenen Immunsystems und wichtig für die Bekämpfung bakterieller Infektionen. Lebensdauer: 5-90 Stunden im Blut; 1-2 Tage im Gewebe. Größe: 10-12 Mikrometer im Durchmesser.
Eosinophile Granulozyten: 1-4% der Leukozyten; Teil des angeborenen Immunsystems und wichtig bei der Bekämpfung von Parasiten und allergischen Reaktionen. Lebensdauer: 8-12 Stunden im Blut; 8-12 Tage im Gewebe.Größe: 12-17 Mikrometer im Durchmesser.
Basophile Granulozyten: <1% der Leukozyten; Teil des angeborenen Immunsystems und beteiligt an allergischen Reaktionen und der Freisetzung von Histamin. Lebensdauer: 1-2 Tage im Blut.Größe: 10-14 Mikrometer im Durchmesser.
Lymphozyten: 20-40% der Leukozyten; spielen eine Schlüsselrolle in der adaptiven Immunantwort. Lebensdauer: Einige Tage bis mehrere Jahre.Größe: 6-10 Mikrometer im Durchmesser für kleine Lymphozyten und bis zu 15 Mikrometer für größere Lymphozyten.
Natürliche Killerzellen: 5-15% der Lymphozyten; Teil des angeborenen Immunsystems, zuständig für die Abtötung von virusinfizierten Zellen und Tumorzellen. Lebensdauer: Wochen bis Monate. Größe: 10-15 Mikrometer im Durchmesser.
Monozyten: 2-8% der Leukozyten; Vorläufer von Makrophagen und dendritischen Zellen. Lebensdauer: 1-3 Tage im Blut; Wochen bis Monate im Gewebe als Makrophagen oder dendritische Zellen.Größe: 15-20 Mikrometer im Durchmesser.
Mastzellen: Obwohl sie nicht im Blut zirkulieren, sind Mastzellen in den Geweben (z. B. Haut, Schleimhäute) wichtig für die Abwehr von Parasiten und spielen eine Schlüsselrolle bei allergischen Reaktionen durch die Freisetzung von Histamin und anderen Mediatoren. Lebensdauer: Wochen bis Monate im Gewebe. Größe: 10-16 Mikrometer im Durchmesser.
Blutplasma
Anteil: Etwa 55% des gesamten Blutvolumens.
Zusammensetzung: Hauptsächlich aus Wasser (ca. 90 Prozent) bestehend.
Funktion: Transport von Nährstoffen, Abfallstoffen und Hormonen.
5.2. Mechanismen der Immunerkennung:
FREMD vs. SELBST
Die Unterscheidung zwischen FREMD und SELBST erfolgt hauptsächlich durch spezialisierte Zellen des Immunsystems, die gezielt die Oberflächen von Zellen scannen – sowohl die des eigenen Körpers als auch die von Pathogenen. Da Zellen weder Augen noch Ohren haben, müssen sie sich berühren, um festzustellen, ob ein Protein zu einem Freund oder Feind gehört. Dafür verfügen sie über eine Vielzahl von Rezeptoren.
Körpereigene Zellen tragen sogenannte SELBST-Marker auf ihrer Oberfläche. Diese Marker sind spezielle Moleküle oder Rezeptoren, die vom Immunsystem erkannt und normalerweise nicht angegriffen werden.
Pathogene hingegen besitzen spezifische Strukturen auf ihrer Oberfläche, die auf körpereigenen Zellen nicht vorhanden sind. Auch fehlerhaft mutierte körpereigene Zellen verraten sich durch Veränderungen auf ihrer Oberfläche. Diese Strukturen können als FREMD-Marker interpretiert werden, die das Immunsystem dazu veranlassen, eine Abwehrreaktion auszulösen.

Doch wie kommunizieren die Zellen des Immunsystems miteinander, um eine koordinierte Reaktion auf Bedrohungen sicherzustellen? Die Antwort liegt in den Botenstoffen, die Zytokine und Chemokine genannt werden.
Zytokine sind kleine Proteine, die wie Signalleuchten wirken und das Verhalten von Immunzellen steuern. Sie regulieren das Wachstum, die Aktivierung und die Funktion von Immunzellen und spielen eine entscheidende Rolle bei der Steuerung von Entzündungsreaktionen. Je nach Bedarf können sie die Immunantwort verstärken oder auch dämpfen.
Chemokine wiederum lenken die Wanderung der Immunzellen durch den Körper. Sie fungieren als Wegweiser, die Immunzellen gezielt an den Ort der Infektion oder Entzündung locken. So stellen sie sicher, dass die Abwehrkräfte genau dort aktiv werden, wo sie gebraucht werden.
SELBST-Marker
SELBST-Marker, auch Autoantigene genannt, dienen als Kennzeichen für körpereigenes Gewebe. Das Immunsystem lernt während seiner Entwicklung, diese Marker zu erkennen und zu tolerieren, um Autoimmunreaktionen zu vermeiden. Dafür hat das Immunsystem mehrere Mechanismen, von denen hier drei wichtige vorgestellt werden:
a) SELBST-Marker: MHC-Moleküle
b) SELBST-Marker: Molekül CD47
c) SELBST-Marker: Sialinsäure
a) SELBST-Marker: MHC-Moleküle
Ein wichtiges Beispiel für SELBST-Marker sind MHC-Moleküle. Der Begriff MHC steht für den Haupthistokompatibilitätskomplex (engl. Major Histocompatibility Complex) und bezeichnet spezielle Proteine auf der Zelloberfläche, die als Rezeptoren fungieren. Diese Rezeptoren präsentieren vor allem körpereigene Proteinfragmente. Dadurch signalisiert die Zelle dem Immunsystem, dass sie zum Körper gehört und keine Bedrohung darstellt.
MHC-Moleküle können jedoch auch fremde Proteinfragmente präsentieren. Diese stammen meist von Krankheitserregern oder erkrankten Zellen, wie zum Beispiel von Viren infizierten Zellen. Indem solche fremden Fragmente auf der Zelloberfläche angezeigt werden, kann das Immunsystem infizierte oder abnorme Zellen erkennen und eine entsprechende Abwehrreaktion einleiten.
Major weist auf die große Bedeutung dieser Gene für die Immunerkennung hin.
Histocompatibility setzt sich aus ‚histo‘ (Gewebe) und ‚compatibility‘ (Verträglichkeit) zusammen und bezieht sich darauf, wie gut Gewebe zwischen verschiedenen Individuen kompatibel oder verträglich sind. MHC spielt eine wesentliche Rolle bei Organtransplantationen.
Complex bezieht sich auf die Gruppe von Genen, die zusammenarbeiten und eine komplexe Funktion erfüllen.
Man unterscheidet zwei Hauptklassen von MHC-Molekülen:
- MHC Klasse I-Moleküle sind auf nahezu allen kernhaltigen Zellen des Körpers zu finden.
- MHC Klasse II-Moleküle sind hauptsächlich auf speziellen Immunzellen zu finden.
Die folgende vereinfachte Grafik zeigt den Unterschied zwischen beiden Klassen. Sowohl MHC-I- als auch MHC-II-Moleküle sind in der Zellmembran verankert und präsentieren Proteinfragmente (Peptide), die als Antigene dienen. Ein struktureller Unterschied besteht darin, dass MHC-Klasse-I-Moleküle eine einzige Verankerung in der Zellmembran haben, während MHC-Klasse-II-Moleküle zwei Verankerungen besitzen.
Generell dienen MHC-Komplexe der Antigenpräsentation, indem sie dem Immunsystem Informationen über den Zustand der Zelle liefern.

Antigenpräsentation
MHC-I präsentiert Antigene, die aus dem Inneren der Zelle stammen. Wie im Abschnitt ‚4.3. Das Protein‘ erwähnt, bauen Zellen kontinuierlich alte oder beschädigte Proteine ab. Dabei zersetzen Proteasome diese Proteine in kleinere Fragmente, sogenannte Peptide. Diese Peptide können von körpereigenen Proteinen stammen und signalisieren dem Immunsystem, dass die Zelle gesund ist. Wenn die Zelle jedoch mit einem Virus infiziert ist oder anderweitig abnormal wird, präsentiert das MHC-I-Molekül Peptide von fremden oder veränderten Proteinen. Dies alarmiert das Immunsystem, dass die Zelle möglicherweise gefährlich ist und beseitigt werden muss.
MHC-Klasse-I-Moleküle werden von allen kernhaltigen Zellen exprimiert.

Ganz links ist eine gesunde Zelle, die über ein MHC-Klasse-I-Molekül ein eigenes, normales Peptid präsentiert. Dies zeigt, dass die Zelle gesund und nicht infiziert ist. Das MHC-I-Molekül signalisiert dem Immunsystem, dass es keinen Handlungsbedarf gibt. In der Mitte ist eine virusinfizierte Zelle, die ebenfalls ein MHC-Klasse-I-Molekül trägt, jedoch ein fremdes Peptid präsentiert, das von einem Virus stammt. Dieses virale Peptid zeigt dem Immunsystem, dass die Zelle infiziert ist, was eine Immunantwort auslösen kann. Rechts ist eine Krebszelle, die über ein MHC-Klasse-I-Molekül ein verändertes Peptid präsentiert. Dieses Peptid ist durch genetische Mutationen im Zuge der Krebsentstehung verändert worden. Es signalisiert dem Immunsystem, dass die Zelle abnormal ist und entfernt werden sollte.
MHC-II hingegen präsentiert Antigene, die von außerhalb der Zelle stammen. MHC-II-Moleküle werden nur von spezialisierten Immunzellen (wie Makrophagen, dendritischen Zellen und B-Zellen) exprimiert. Diese Zellen nehmen fremdes Material, wie Bakterien oder andere Erreger, auf, zerlegen es in kleinere Fragmente (Antigene) und präsentieren diese dann an der Zelloberfläche. Die so präsentierten Antigene aktivieren bestimmte Immunzellen, die eine gezielte Immunantwort koordinieren.
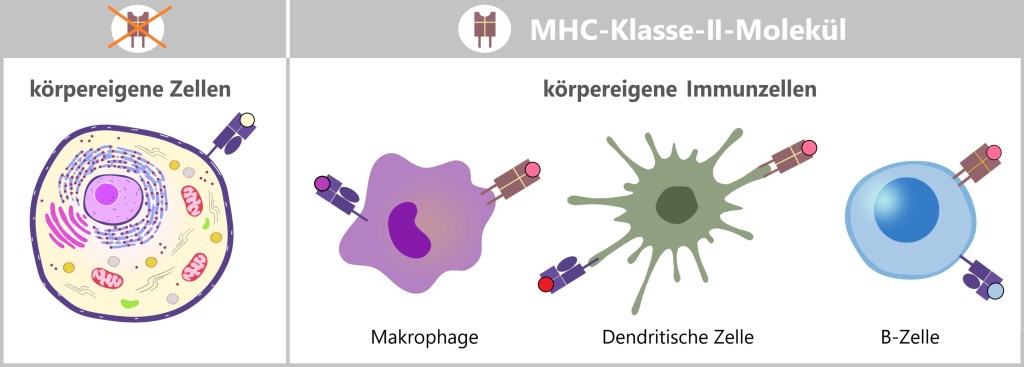
MHC-Moleküle ermöglichen es dem Immunsystem, zwischen körpereigenen und fremden oder veränderten Zellen zu unterscheiden. Dies ist entscheidend, um gesunde Zellen zu schützen und gleichzeitig eine Immunreaktion gegen potenziell schädliche Eindringlinge oder abnorme Zellen auszulösen.
Die kurze Animation zur Antigenpräsentation: MHC Klasse I vs. MHC Klasse II veranschaulicht anschaulich die zuvor erklärten Zusammenhänge.
MHC-Moleküle und deren Vielfalt
Was sind MHC-Moleküle?
MHC-Moleküle sind spezielle Proteine auf der Oberfläche unserer Zellen. Sie helfen dem Immunsystem dabei, zwischen eigenen und fremden Stoffen, wie z. B. Krankheitserregern, zu unterscheiden. MHC-Moleküle werden von bestimmten Genen in unserem Körper gebildet.
Was sind Allele?
Diese Gene, die die MHC-Moleküle herstellen, gibt es in vielen verschiedenen Versionen, die Allele genannt werden. Jeder Mensch hat eine einzigartige Kombination von Allelen, was dazu führt, dass die MHC-Moleküle bei jedem Menschen ein wenig anders aussehen.
Warum gibt es so viele Varianten?
Es gibt Hunderte von verschiedenen Allelen in der Bevölkerung. Diese große Vielfalt hilft dem Immunsystem, eine größere Bandbreite an Krankheitserregern zu erkennen. Das bedeutet, dass einige Menschen gegen bestimmte Krankheiten besser geschützt sind als andere – was aus evolutionärer Sicht ein Vorteil ist. [Haupthistokompatibilitätskomplex]
Wie funktionieren MHC-Moleküle?
Jedes MHC-Molekül kann kleine Bruchstücke von Proteinen, sogenannte Peptide, binden. Diese Peptide entstehen, wenn Proteine im Körper abgebaut werden. MHC-Moleküle präsentieren diese Peptide dann auf der Zelloberfläche, damit das Immunsystem erkennen kann, ob die Zelle gesund ist oder von einem Virus oder anderen Krankheitserregern befallen wurde.
Warum ist diese Vielfalt wichtig?
Die Vielfalt der MHC-Moleküle bedeutet, dass verschiedene Menschen verschiedene Peptide binden und präsentieren können. Das macht es Krankheitserregern schwerer, alle Menschen gleich zu infizieren, da das Immunsystem jedes Menschen anders auf sie reagiert.
Organtransplantation und MHC-Moleküle
Die Vielfalt der MHC-Moleküle ist auch der Grund, warum es schwierig ist, passende Organspender zu finden. Wenn die MHC-Moleküle des Spenders nicht gut zu denen des Empfängers passen, kann das Immunsystem des Empfängers das neue Organ als fremd erkennen und es angreifen. Deshalb müssen bei einer Organtransplantation die MHC-Moleküle von Spender und Empfänger sorgfältig verglichen werden, um die Abstoßungsgefahr zu verringern.
b) SELBST-Marker: Molekül CD47
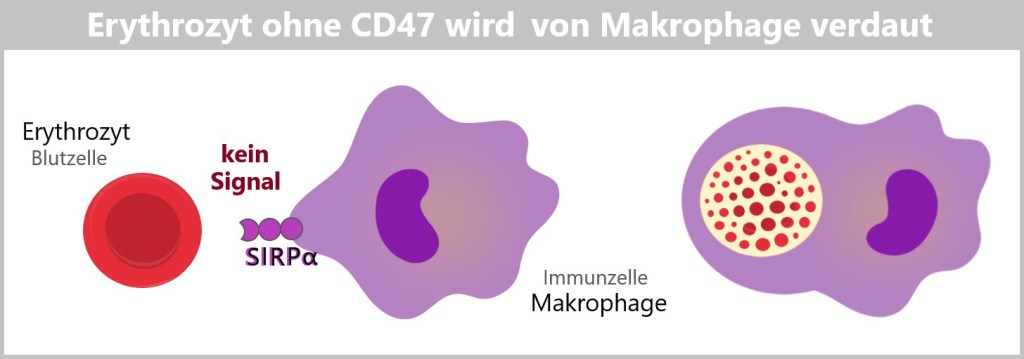
Ein weiterer wichtiger SELBST-Marker auf der Oberfläche von Zellen ist das Molekül CD47. Dieses Molekül fungiert als ein ‚Don’t eat me‘-Signal, was bedeutet, dass es Immunzellen daran hindert, die Zelle zu zerstören.
CD47 spielt eine entscheidende Rolle bei der Regulation der Immunantwort und dem Schutz von Blutzellen. Im Gegensatz zu MHC-Klasse-I-Molekülen, die nur auf kernhaltigen Zellen zu finden sind, kommt CD47 auf allen Zelltypen vor, einschließlich kernloser Zellen wie Erythrozyten (rote Blutkörperchen) und Thrombozyten (Blutplättchen).
CD47 bindet an ein Rezeptorprotein namens SIRPα (Signal Regulatory Protein Alpha), das auf der Oberfläche von Immunzellen vorhanden ist. Diese Bindung sendet ein Signal, das die Immunzelle davon abhält, die Zelle anzugreifen. Dadurch wird sichergestellt, dass gesunde, körpereigene Zellen nicht vom Immunsystem zerstört werden.

Wenn der CD47-Marker fehlt oder nicht richtig funktioniert, kann die Zelle als „fremd“ oder „verändert“ erkannt werden. Dies führt dazu, dass Immunzellen diese Zellen angreifen und beseitigen.
CD47-Moleküle unterscheiden sich nicht so stark von Mensch zu Mensch wie die MHC-Klasse-I-Moleküle. Sie haben bei den meisten Menschen eine relativ konservierte Struktur, was bedeutet, dass es weniger Variationen gibt. Diese Konservierung ist wichtig, da CD47 eine grundlegende Funktion in der Immunregulation und Zellinteraktion hat.
Aus diesem Grund funktioniert eine Bluttransfusion in der Regel einfacher als eine Organtransplantation. Bei einer Bluttransfusion müssen nur wenige Antigene (wie die Blutgruppenmerkmale) berücksichtigt werden, während es bei einer Organtransplantation eine hohe Variabilität in den MHC-Klasse-I-Molekülen gibt, die eine starke Immunantwort auslösen können.
c) SELBST-Marker: Sialinsäure
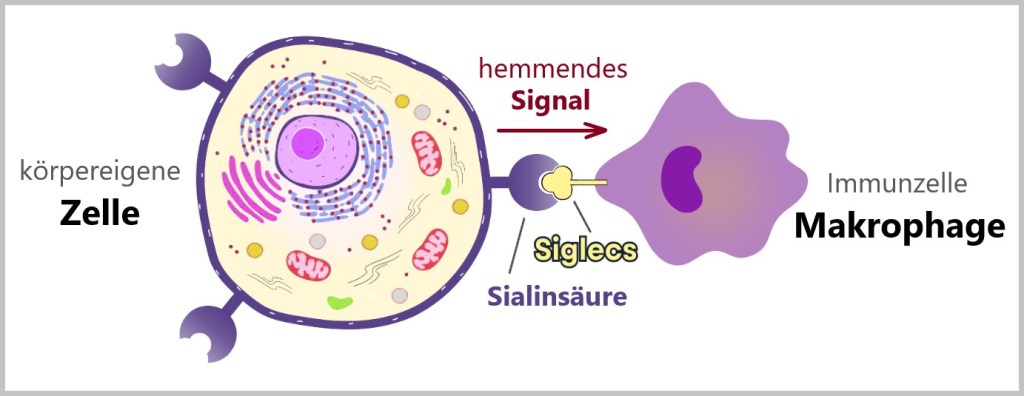
Ein weiterer bedeutender SELBST-Marker auf der Zelloberfläche ist Sialinsäure. Sialinsäuren sind eine Gruppe von Zuckermolekülen, die auf den Oberflächen von Zellen vorkommen und eine wichtige Rolle bei der Zell-Zell-Kommunikation spielen. Alle körpereigenen Zellen tragen Sialinsäure auf ihrer Oberfläche.
Spezielle Rezeptoren auf der Oberfläche von Immunzellen können die Sialinsäuren erkennen und an ihnen binden. Diese Sialinsäure-bindenden Rezeptoren werden als Siglecs (Sialic acid-binding immunoglobulin-type lectins) bezeichnet. Wenn Sialinsäuren an Siglecs binden, senden sie inhibierende (hemmende) Signale in die Immunzelle. Das hält die Immunzelle davon abhält, die Zelle anzugreifen. Dieser Mechanismus schützt körpereigene Zellen vor Angriffen durch das Immunsystem.
Kombination dieser SELBST-Marker
Eine Zelle kann sowohl MHC-Moleküle, CD47 als auch Sialinsäure gleichzeitig auf ihrer Oberfläche tragen. Jede dieser Molekülgruppen erfüllt eine wichtige Funktion, um die Zelle als körpereigen zu kennzeichnen und vor einer unnötigen Immunantwort zu schützen. Während MHC vor allem der Antigenpräsentation dient, sorgen CD47 und Sialinsäure dafür, dass Zellen nicht von Immunzellen angegriffen oder eliminiert werden. Diese Marker wirken also in Kombination, um das Immunsystem effizient zu steuern.
5.3. Die unspezifische Immunabwehr
Unser Immunsystem überwacht den Körper fortwährend auf das Vorhandensein von Fremdstoffen und Zellveränderungen. Sobald etwas als Gefahr erkannt wird, startet die Abwehrreaktion. Die unspezifische Immunantwort setzt dabei besonders schnell ein – innerhalb von Minuten bis wenigen Stunden ist sie vollständig aktiviert.
Diese Form der Immunabwehr ist nicht auf bestimmte Erreger spezialisiert. „Unspezifisch“ bedeutet, dass auf jede erkannte Bedrohung eine allgemeine Standardreaktion erfolgt; Krankheitserreger werden unabhängig von ihrer Art auf die gleiche Weise bekämpft. Das unspezifische Immunsystem ist bereits bei der Geburt vorhanden, weshalb es auch als natürliches oder angeborenes Immunsystem bezeichnet wird. Im ersten Schritt versucht der Organismus, das Eindringen von Krankheitserregern zu verhindern oder zumindest zu erschweren.
I – Erste Verteidigungslinie: mechanische und chemische Barrieren
II – Zweite Verteidigungslinie: die weißen Blutkörperchen
5.3. a) Granulozyten
5.3. b) Makrophagen
5.3. c) Dendritische Zellen
5.3. d) Natürliche Killerzellen
I – Erste Verteidigungslinie: mechanische und chemische Barrieren
Die erste Verteidigungslinie unseres Körpers gegen Krankheitserreger besteht aus mechanischen und chemischen Barrieren.
Mechanische Barrieren
Zu den mechanischen Barrieren zählen die Haut und alle Schleimhäute. Die Haut, die Grenze zwischen Körperinnerem und äußerer Umwelt, ist der wichtigste Schutz unseres Körpers gegen Krankheitserreger. Sie besteht aus mehreren Schichten, die das Eindringen von Pathogenen verhindern. Die äußerste Schicht, die Epidermis, erneuert sich regelmäßig. Abgestorbene Hautzellen werden ständig abgestoßen und durch neue Zellen ersetzt. Dieser Erneuerungsprozess trägt dazu bei, an der Haut haftende Mikroorganismen zu entfernen.
Schleimhäute befinden sich in vielen Bereichen unseres Körpers, einschließlich der Nase, des Mundes, des Rachens, der Lunge und des Verdauungstrakts. Sie produzieren Schleim, eine klebrige Substanz, die Krankheitserreger einfängt und entfernt. Beispielsweise fängt der Schleim in unserer Nase Staub und Mikroorganismen ein, die wir einatmen, und verhindert so, dass sie in unsere Lunge gelangen.
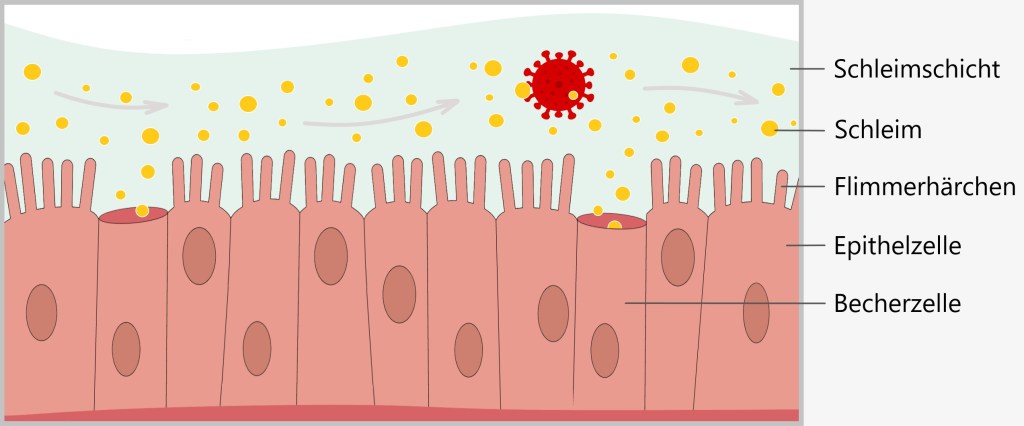
Schleimhautzellen besitzen viele Flimmerhärchen (Zilien), die wie dichter Rasen nebeneinander liegen. Becherzellen produzieren unentwegt Schleim, der die Flimmerhärchen umgibt und die Oberfläche der Schleimhaut bedeckt. In dieser zähflüssigen Schleimschicht verfangen sich leicht Fremdpartikel wie Viren, Bakterien oder Staub.
Die Flimmerhärchen bewegen sich wellenartig, um die Fremdpartikel, die in den Schleim geraten, aus den Atemwegen zu befördern. Ähnlich wie ein Förderband schieben die Flimmerhärchen die Schleimschicht mitsamt den Fremdkörpern in Richtung Rachen. Dort wird das Sekret durch Niesen oder Husten nach außen befördert oder verschluckt. Dieser Selbstreinigungsmechanismus ist ständig aktiv.
Chemische Barrieren
Zusätzlich blockieren chemische Stoffe wie Säuren, Enzyme oder Schleim die Anlagerung von Krankheitserregern. Einige Bereiche unseres Körpers, wie die Haut und der Magen, haben ein saures Milieu. Diese saure Umgebung ist für viele Mikroorganismen ungünstig und kann ihr Wachstum hemmen oder sie abtöten. Vor allem im Säurebad des Magens werden viele Krankheitserreger unschädlich gemacht.
Enzyme sind Proteine, die chemische Reaktionen katalysieren. Einige Enzyme in unserem Körper, wie Lysozym in unserem Speichel und Tränen, können die Zellwände von Bakterien abbauen und sie so abtöten. Wie bereits erwähnt, produzieren unsere Schleimhäute Schleim, der Krankheitserreger einfängt. Aber Schleim dient auch als chemische Barriere. Er enthält antimikrobielle Substanzen wie Immunglobuline, die Krankheitserreger neutralisieren können.
Obwohl die mechanischen und chemischen Barrieren unseres Körpers äußerst effektiv sind, um das Eindringen von Krankheitserregern zu verhindern, können einige Erreger dennoch diese Barrieren überwinden. Sobald Krankheitserreger die ersten Barrieren durchdrungen haben, tritt unser Körper in eine weitere Verteidigungslinie ein.
II – Zweite Verteidigungslinie: die weißen Blutkörperchen
Gelingt es den Krankheitserregern, die erste Verteidigungslinie zu überwinden und in den Körper einzudringen, bleiben sie nicht lange unbemerkt. Spezialisierte Immunzellen wie Granulozyten, Makrophagen, dendritische Zellen und natürliche Killerzellen stehen zur Abwehr bereit. Diese Zellen gehören zu den weißen Blutkörperchen, den Leukozyten.
Granulozyten, Monozyten und natürliche Killerzellen zirkulieren im Blut und wandern bei Bedarf ins Gewebe. Wenn Monozyten ins Gewebe einwandern, entwickeln sie sich zu Makrophagen oder dendritischen Zellen, die dann dort ansässig sind und ihre Immunfunktion übernehmen.

5.3. a) Granulozyten
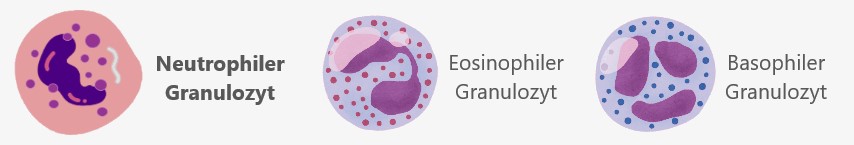
Granulozyten sind eine Untergruppe der weißen Blutkörperchen, die sich durch charakteristische Granula – kleine, körnchenartige Strukturen im Zytoplasma – auszeichnen. Diese Granula enthalten verschiedene Substanzen, die bei der Immunabwehr und anderen Prozessen freigesetzt werden. Zu den Granulozyten zählen neutrophile, eosinophile und basophile Granulozyten, die jeweils unterschiedliche Aufgaben im Immunsystem übernehmen, insbesondere bei der Bekämpfung von Infektionen und allergischen Reaktionen. In der weiteren Beschreibung konzentrieren wir uns auf die neutrophilen Granulozyten, da sie mit einem Anteil von 50-70 % der Leukozyten im menschlichen Blut die zahlreichsten Immunzellen sind.
Neutrophile Granulozyten, kurz Neutrophile, zirkulieren kontinuierlich im Blutkreislauf und gehören zu den ersten Immunzellen, die auf eine Infektion reagieren. Dringen Krankheitserreger in den Körper ein, werden chemotaktische Signale freigesetzt, die Neutrophile an den Infektionsort locken. Daraufhin verlassen sie die Blutbahn und wandern ins Gewebe ein, wo sie innerhalb weniger Minuten den Infektionsherd erreichen können.
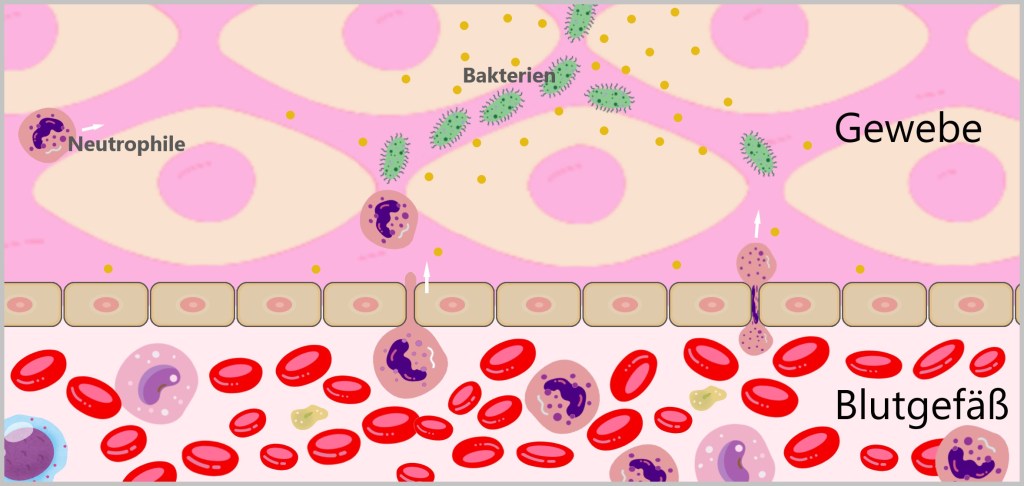
Vor Ort erkennen sie Pathogene mit ihren Mustererkennungsrezeptoren (PRRs, engl. Pattern Recognition Receptors) die spezifische Pathogen-assoziierte molekulare Muster PAMPs (engl. Pathogen-associated molecular patterns) auf Eindringlingen wie Bakterien, Viren und Pilzen identifizieren. Ihre PRRs erkennen auch Schaden-assoziierte molekulare Muster (DAMPs,engl. Damage-associated molecular patterns), die von geschädigten oder gestressten Zellen freigesetzt werden.
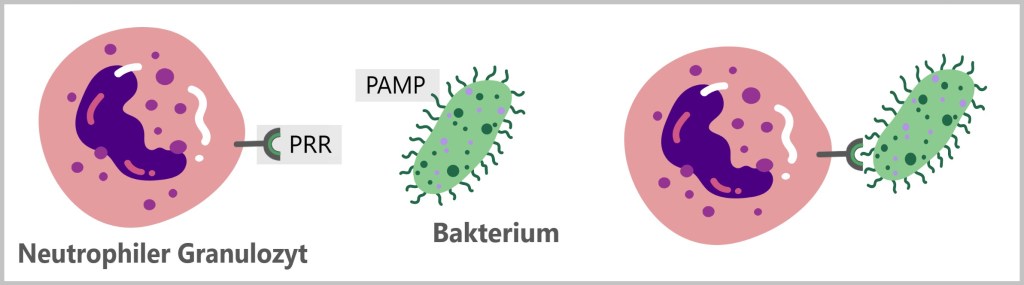
Mustererkennungsrezeptoren (PRRs)
Mustererkennungsrezeptoren (PRRs) sind eine zentrale Komponente des angeborenen Immunsystems. Sie dienen dazu, Krankheitserreger und Zellschäden schnell zu erkennen und eine sofortige Immunantwort einzuleiten. PRRs erkennen spezifische molekulare Muster, die entweder mit Pathogenen (Krankheitserregern) oder mit Zellschäden assoziiert sind.
Diese molekularen Muster werden in zwei Hauptkategorien unterteilt:
Pathogen-assoziierte molekulare Muster (PAMPs): Diese Moleküle sind typisch für Mikroorganismen wie Bakterien, Viren, Pilze und Parasiten, aber nicht für menschliche Zellen.
Schaden-assoziierte molekulare Muster (DAMPs): Diese Moleküle werden von gestressten oder beschädigten Zellen freigesetzt und signalisieren eine Gefahr für den Organismus.
PRRs lassen sich in verschiedene Klassen unterteilen, die jeweils auf unterschiedliche Arten von PAMPs und DAMPs spezialisiert sind:
Toll-like Rezeptoren (TLRs)
TLRs sind spezielle Sensoren auf der Oberfläche von Immunzellen wie Makrophagen, dendritischen Zellen und Neutrophilen sowie in deren inneren Bereichen. TLRs erkennen eine breite Palette von PAMPs:
TLR1 und TLR2: Diese beiden arbeiten oft zusammen und erkennen bestimmte Moleküle auf der Oberfläche von Bakterien.
TLR3: Dieser Rezeptor erkennt virale RNA, also das genetische Material von Viren.
TLR4: Er erkennt Lipopolysaccharide, die auf der Oberfläche vieler Bakterien vorkommen.
TLR5: Dieser Rezeptor erkennt Flagellin, ein Protein, das in den Geißeln von Bakterien vorkommt.
TLR6: Arbeitet oft mit TLR2 zusammen und erkennt ebenfalls Moleküle auf Bakterien.
TLR7 und TLR8: Diese beiden erkennen virale RNA, ähnlich wie TLR3.
TLR9: Er erkennt DNA von Bakterien und Viren, die bestimmte Muster aufweist.
NOD-like Rezeptoren (NLRs)
NLRs sind intrazelluläre Rezeptoren, die im Zytoplasma von Zellen vorkommen. Man kann sie sich wie winzige Sensoren vorstellen, die ständig nach Anzeichen für Infektionen oder Zellschäden Ausschau halten. Diese Sensoren erkennen bestimmte Moleküle, die entweder von Krankheitserregern wie Bakterien stammen oder die in unseren Zellen auftreten, wenn sie gestresst oder beschädigt sind.
RIG-I-like Rezeptoren (RLRs)
RLRs sind ebenfalls intrazelluläre Rezeptoren, die im Zytoplasma von Zellen lokalisiert sind. Sie sind darauf spezialisiert, Viren zu erkennen, die in die Zelle eingedrungen sind.
C-Typ-Lektin-Rezeptoren (CLRs)
CLRs befinden sich auf der Zelloberfläche von Immunzellen wie Makrophagen und dendritischen Zellen. Sie erkennen bestimmte Zuckerstrukturen (Kohlenhydrate) auf der Oberfläche von Krankheitserregern, insbesondere von Pilzen.
Neutrophile Granulozyten beseitigen Eindringlinge oder kranke Zellen, indem sie diese aufnehmen und zerstören. Dabei umschließen sie den Erreger in einem membranumhüllten Bläschen, dem sogenannten Phagosom. Nach der Aufnahme verschmelzen die Granula der Neutrophilen mit dem Phagosom. Diese Granula enthalten Enzyme und antimikrobielle Substanzen, die den eingeschlossenen Erreger abbauen und abtöten. Die verbleibenden Abbauprodukte, die nicht weiterverwertet werden können, werden anschließend aus den Neutrophilen freigesetzt. Diese Reste können von anderen Immunzellen, wie Makrophagen, aufgenommen und weiterverarbeitet werden.
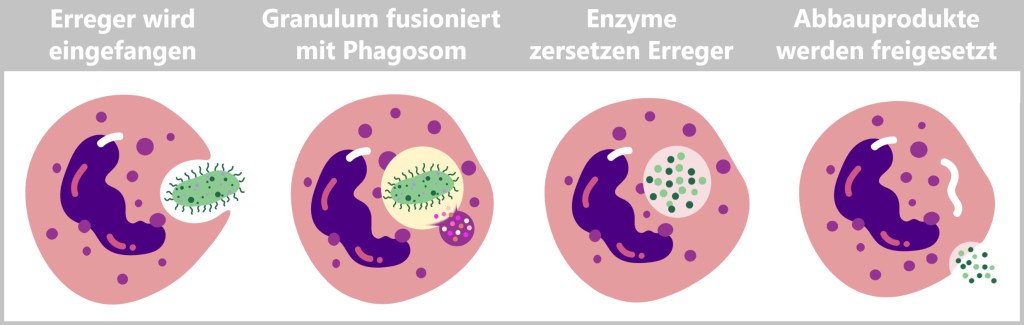
Zusätzlich beseitigen Neutrophile auch zerstörte Gewebezellen. Dieser gesamte Prozess, bei dem die Zellen Fremdkörper und geschädigte Zellen einverleiben und abbauen, wird als Phagozytose bezeichnet.
Das Wort Phagozytose stammt aus dem Griechischen und setzt sich aus zwei Teilen zusammen: Phagein bedeutet „essen“ oder „verschlingen“ und Kytos bedeutet „Zelle“ oder „Behälter“. Der Begriff „Phagozytose“ beschreibt also wörtlich das „Zellfressen“ oder „Verschlingen durch Zellen“. Daher werden Fresszellen auch als Phagozyten bezeichnet.
Neutrophile haben eine relativ kurze Lebensdauer und sterben nach der Phagozytose und Verdauung von Pathogenen oft ab. Dieser Prozess, genannt Apoptose (programmierter Zelltod), hilft dabei, die Entzündungsreaktion zu regulieren.
Wenn viele Neutrophile in einem infizierten Bereich sterben, sammeln sich ihre Überreste zusammen mit den verdauten Pathogenen und Zelltrümmern an. Diese Ansammlung von toten Zellen und Abbauprodukten bildet Eiter. Eiter ist eine zähe, gelbliche oder grünliche Flüssigkeit, die oft in infizierten Wunden oder Abszessen gefunden wird. Auch apoptotische (abgestorbene) Neutrophile werden von Makrophagen aufgenommen und verdaut, wodurch das umliegende Gewebe gereinigt und die Heilung unterstützt wird.
In einigen Fällen setzen Neutrophile netzartige Strukturen frei, die aus DNA und antimikrobiellen Proteinen bestehen. Diese NETs (Neutrophil Extracellular Traps) fangen Pathogene ein und töten sie ab, indem sie ihre Bewegung und Vermehrung verhindern.

Dieses kurze Animationsvideo zeigt sehr schön die Funktionsweise der Neutrophilen.
Neutrophile arbeiten eng mit anderen Immunzellen wie Makrophagen und dendritischen Zellen zusammen, indem sie Signalmoleküle freisetzen. Diese Signalmoleküle, wie Chemokine und Zytokine, rekrutieren und aktivieren weitere Immunzellen zum Ort der Infektion. Damit tragen Neutrophile wesentlich zur Entzündungsreaktion bei. Ihre rasche Reaktion und Fähigkeit zur effektiven Pathogenbekämpfung macht sie zu einer entscheidenden Komponente der angeborenen Immunantwort.

5.3. b) Makrophagen
Makrophagen sind große Fresszellen, deren Name sich vom griechischen ‚Macro‘ für groß und ‚Phage‘ für Fresser ableitet. Es gibt verschiedene Arten von Makrophagen.
Residente Makrophagen sind fest im Gewebe verankert. Rekrutierte Makrophagen entstehen aus den im Blut zirkulierenden Monozyten. Wenn Monozyten mit Zytokinen (Botenstoffen) in Kontakt kommen, wandern sie aus dem Blut ins Gewebe und differenzieren sich dort zu Makrophagen. Einmal im Gewebe, bleiben sie oft stationär und patrouillieren umher, auf der Suche nach Krankheitserregern und abgestorbenen Zellen.
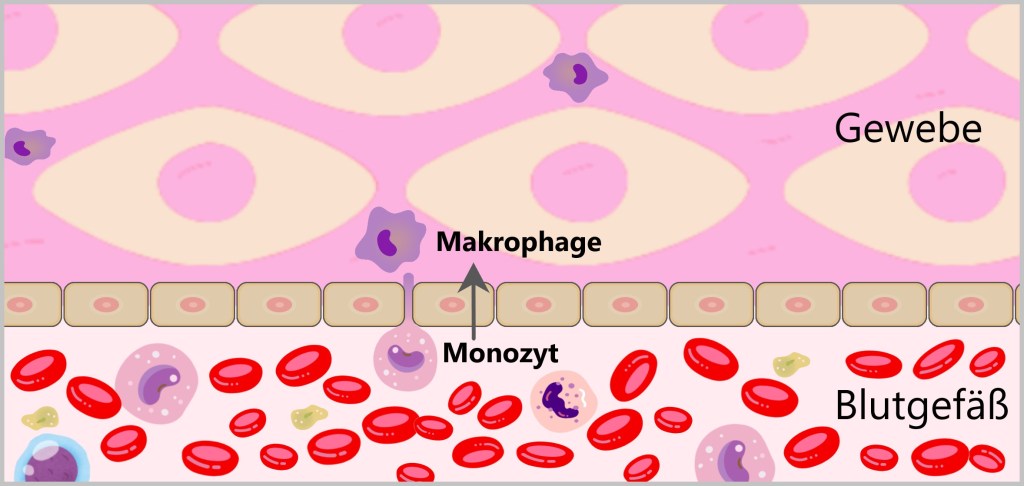
Makrophagen erkennen Krankheitserreger durch spezielle Proteine auf deren Oberfläche, die Pathogen-assoziierte molekulare Muster (PAMPs). Diese Oberflächenproteine der Erreger passen in die Mustererkennungsrezeptoren (PRRs) der Makrophagen wie ein Schlüssel in ein Schloss. Auch Zelltrümmer oder abgestorbene Zellen bilden spezifische ‚eat-me‘-Signale, die von Makrophagen auf ähnliche Weise erkannt werden. Sobald der Krankheitserreger oder Zellabfall erkannt wurde, bindet die Makrophage an ihn, umschließt ihn mit ihrer beweglichen Membran und leitet die Phagozytose ein.
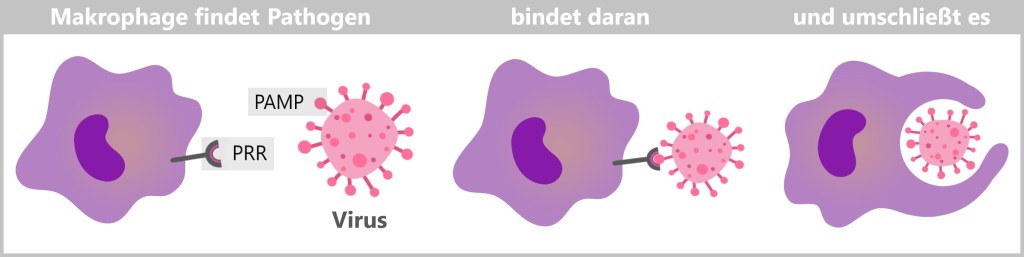
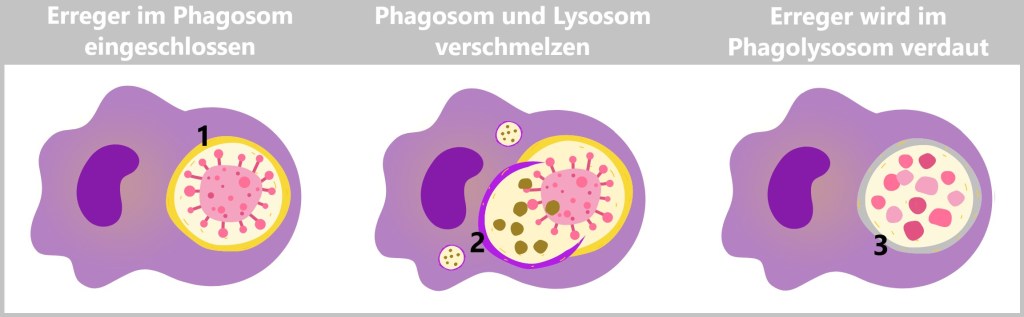
Bei der Phagozytose nimmt die Makrophage den Erreger oder Zelltrümmer durch Einstülpen in sich auf und bildet ein membranumhülltes Bläschen, das Phagosom. Dieses Phagosom fusioniert mit einem Lysosom, wodurch ein Phagolysom entsteht. Im Phagolysom werden die aufgenommenen Partikel durch die Verdauungsenzyme des Lysosoms abgebaut. Hier kannst du dir Makrophagen in Aktion anschauen.
Die Phagozytose ist ein uralter Mechanismus, der bis zu den einzelligen Eukaryoten wie Amöben zurückreicht, und bietet ein anschauliches Beispiel dafür, wie sich das Immunsystem über Millionen von Jahren entwickelt hat.
Phagozytose: Ein uralter Überlebensmechanismus
Ein schönes Beispiel, wie sich das Immunsystem im Laufe von Jahrmillionen entwickelt hat, ist die Phagozytose.
Die Geschichte der Phagozytose reicht weit zurück und ist eng mit der Evolution des Lebens verbunden. Bereits einzellige Organismen wie Amöben nutzen seit mehr als 100 Millionen Jahren die Phagozytose, um Nahrung aufzunehmen. Um ihre Nahrung aufzuspüren, besitzen sie Rezeptoren, die auf spezifische chemische Substanzen reagieren, die von Bakterien oder anderen potenziellen Nahrungsquellen freigesetzt werden. Amöben bewegen sich in Richtung dieser Signale durch einen Prozess, der Chemotaxis genannt wird. Dann umschließen sie ihre Beute mit ihrer Zellmembran und bilden sogenannte Nahrungsvakuolen, in denen die Verdauung stattfindet.
Amöben sind somit hervorragende Beispiele für die frühen Nutzer der Phagozytose. Sie sind uralte Lebensformen, die in ihrer Struktur einfach, aber in ihrer Funktion sehr effektiv sind. Der Phagozytose-Mechanismus könnte evolutionär sogar als Grundlage für den Zellfusionsprozess gedient haben, der schließlich zur Entstehung der eukaryotischen Zelle führte, welche komplexere Organismen ermöglichte.
Quellen:
Die Ursprünge der Phagozytose und Eukaryogenese
The Endosymbiotic Theory
Entdeckung durch Ilya Metschnikow
Der eigentliche Begriff „Phagozytose“ wurde erstmals Ende des 19. Jahrhunderts von dem russischen Biologen Ilya Metschnikow geprägt, der als Pionier der Immunbiologie gilt. Während eines Aufenthalts in Italien führte Metschnikow Untersuchungen an Seesternen durch und beobachtete, wie bestimmte Zellen Krankheitserreger oder Fremdpartikel verschlangen. Diese Zellen nannte er „Phagozyten“ (griechisch: „Fresszellen“), und den Prozess selbst bezeichnete er als „Phagozytose“. Für diese Entdeckung erhielt Metschnikow 1908 den Nobelpreis für Medizin.
Evolution der Phagozytose im Immunsystem
Im Laufe der Evolution hat sich die Phagozytose von einem Mechanismus zur Nahrungsaufnahme zu einer zentralen Komponente des Immunsystems entwickelt. Immunzellen wie Makrophagen, dendritische Zellen und neutrophile Granulozyten im angeborenen Immunsystem haben die Phagozytose verfeinert und nutzen diese Fähigkeit nicht nur, um Krankheitserreger zu erkennen, zu verschlingen und zu zerstören, sondern auch zur Kommunikation mit anderen Immunzellen.
Das „Spazierentragen“ der Antigene auf der Zelloberfläche ist dabei ein echter evolutionärer Kniff: Die Immunzellen präsentieren Bruchstücke der verdauten Erreger (Antigene), um andere Zellen des Immunsystems zu alarmieren. Während Amöben ihre Beute also einfach nur verdauen, haben Immunzellen gelernt, daraus eine „Botschaft“ für den Körper zu machen!
Makrophagen konzentrieren sich hauptsächlich auf das „Fressen“ von Krankheitserregern und das „Aufräumen“ von Zelltrümmern. Dabei entsteht jedoch auch die Möglichkeit der Antigenpräsentation.
Während des Abbaus werden kleinere Fragmente freigesetzt, darunter potenzielle Antigene, die an MHC-Klasse-II-Moleküle gebunden und auf der Zelloberfläche präsentiert werden. Diese Antigenpräsentation ist entscheidend für die Aktivierung anderer Immunzellen, insbesondere der T-Zellen. Die Antigen-MHC-II-Komplexe werden den T-Zellen präsentiert, die daraufhin die spezifische Immunantwort einleiten – ein Prozess, auf den wir in den kommenden Abschnitten noch ausführlicher eingehen werden.
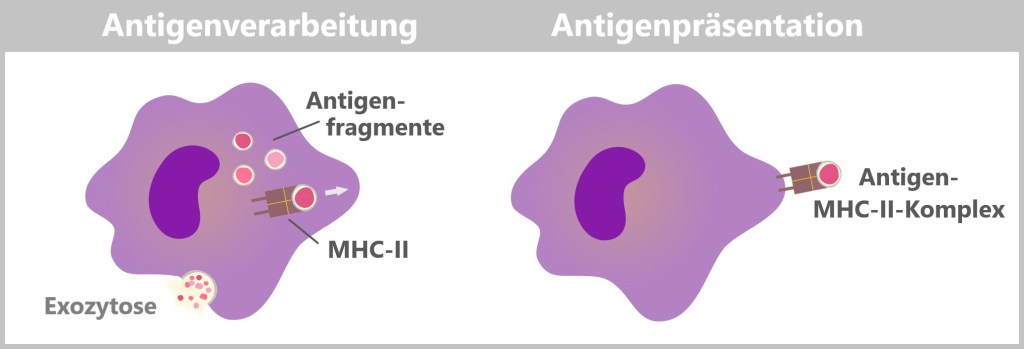
Viele weitere kleinere Moleküle, die durch den Verdauungsprozess entstehen, wie Aminosäuren, Zucker und Lipide, können von der Makrophage als Nährstoffe wiederverwendet werden.
Andere Abfallprodukte und unverdauliche Reste werden in Vesikel verpackt und aus der Zelle ausgeschieden. Dies verhindert die Ansammlung von Abfall innerhalb der Makrophage und ermöglicht ihr, weiter zu arbeiten. Einige der unverdaulichen Reste können letztlich über verschiedene Ausscheidungsprozesse des Körpers entfernt werden, wie beispielsweise über den Urin, den Stuhl oder durch Schwitzen. Dies erfolgt nach weiterem Abbau und Transport durch das lymphatische System oder die Blutbahn zu den entsprechenden Organen wie den Nieren oder dem Darm.
Makrophagen sind sehr effiziente Phagozyten und können eine große Anzahl von Pathogenen und Zellabfällen aufnehmen und abbauen. Innerhalb weniger Stunden kann eine Makrophage Hunderte von Bakterien phagozytieren.
Da in der Regel nicht nur ein einziger Krankheitserreger in den Körper eindringt, rufen Makrophagen weitere Immunzellen zu Hilfe. Dazu sondern sie Zytokine ab, die die Immunantwort verstärken.
Die Zytokine bewirken, dass sich die Blutgefäße in der Umgebung der Infektionsstelle erweitern. Dies führt zu einer erhöhten Durchblutung, wodurch mehr Immunzellen, Sauerstoff und Nährstoffe zur betroffenen Stelle gelangen. Dadurch kommt es zu einer Schwellung (Ödem) im Gewebe, was auch die Rötung und Wärme erklärt, die oft mit Entzündungen einhergehen.

Im weiteren Verlauf stoßen Makrophagen den Heilungsprozess an, indem sie Wachstumsfaktoren freisetzen, die die Zellteilung und -differenzierung fördern.
Makrophagen spielen eine zentrale Rolle in der unmittelbaren Immunabwehr. Ihre Hauptaufgaben sind die Bekämpfung und Beseitigung von Pathogenen sowie das Aufräumen von Zelltrümmern durch Phagozytose. Dazu besitzen Makrophagen etwa 60 verschiedene Arten von Rezeptoren, die es ihnen ermöglichen, eine Vielzahl von Krankheitserregern zu erkennen. Zusätzlich übernehmen sie die Antigenpräsentation, um die spezifische Immunantwort zu unterstützen, obwohl dies eher eine ergänzende Funktion ist. Im Gegensatz dazu sind dendritische Zellen spezialisierter auf die Sammlung und Präsentation von Antigenen, um gezielt die adaptive Immunabwehr zu aktivieren.

5.3. c) Dendritische Zellen
Dendritische Zellen sind spezialisierte Immunzellen, die eine Schlüsselrolle bei der Auslösung der spezifischen Immunantwort einnehmen. Der Name leitet sich von ihren zahlreichen, verzweigten Fortsätzen ab, die an die Dendriten von Nervenzellen erinnern.
Dendritische Zellen entstehen aus Vorläuferzellen im Knochenmark und differenzieren sich im Gewebe weiter. Sie sind in nahezu allen Geweben des Körpers zu finden, insbesondere an den Grenzflächen zur Außenwelt wie Haut, Atemwege und Magen-Darm-Trakt, wo sie kontinuierlich auf der Suche nach Antigenen sind. Im Gewebe können sie sich in verschiedene Untertypen entwickeln, die jeweils spezifische Aufgaben bei der Erkennung und Präsentation von Antigenen übernehmen.
Dendritische Zellen erkennen Krankheitserreger und Fremdstoffe durch spezielle Rezeptoren auf ihrer Oberfläche, die sogenannten Mustererkennungsrezeptoren (PRRs). Diese Rezeptoren binden an charakteristische Molekülmuster auf den Pathogenen, die als Pathogen-assoziierte molekulare Muster (PAMPs) bekannt sind. Auch beschädigte oder abgestorbene Zellen senden spezifische „eat-me“-Signale aus, die von den dendritischen Zellen erkannt werden.
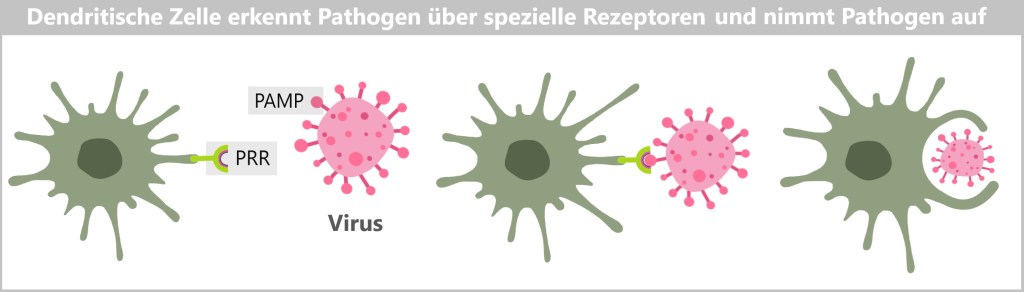
Sobald dendritische Zellen Krankheitserreger oder Zelltrümmer aufgenommen haben, durchlaufen sie einen Reifungsprozess. Dieser Prozess beginnt mit der Erkennung der PAMPs auf den Pathogenen durch die PRRs. Nach dieser Erkennung phagozytieren die dendritischen Zellen die Pathogene oder Zellabfälle und schließen sie in einem membranumhüllten Bläschen, dem Phagosom, ein. Innerhalb des Phagosoms werden die aufgenommenen Materialien durch Verdauungsenzyme abgebaut.
Während dieses Abbaus entstehen kleinere Fragmente, die als Antigene bezeichnet werden. Diese Antigene werden dann an MHC-Klasse-II-Moleküle gebunden und auf der Zelloberfläche präsentiert.

Nach der Aufnahme und Verarbeitung von Antigenen wandern dendritische Zellen in die nächstgelegenen Lymphknoten, wo sie die Antigene den T-Zellen präsentieren und so die Aktivierung der spezifischen Immunantwort initiieren.
Obwohl dendritische Zellen auch als Phagozyten in der angeborenen Immunabwehr eine wichtige Rolle spielen, liegt ihre Hauptfunktion als Antigen-präsentierende Zellen (APCs) in der Aktivierung der spezifischen Immunabwehr. Daher werden wir uns im Kapitel ‚Die spezifische Immunabwehr‘ ausführlich mit ihrer Rolle als APC beschäftigen.
Neben der Aktivierung der spezifischen Immunantwort können dendritische Zellen auch regulierend wirken. Je nach Kontext und den empfangenen Signalen können sie sowohl immunstimulierende als auch immunsuppressive Funktionen übernehmen, und tragen so zur Feinabstimmung der Immunreaktionen bei.

5.3. d) Natürliche Killerzellen
Natürliche Killerzellen (NK-Zellen) sind eine Art von Lymphozyten, die zu den Leukozyten (weißen Blutkörperchen) gehören. Sie entwickeln sich aus lymphatischen Stammzellen im Knochenmark und sind ein essenzieller Bestandteil der angeborenen Immunantwort.
NK-Zellen zirkulieren im Blut und haben die Aufgabe, den Zelltod (Apoptose) bestimmter Zellen, insbesondere virusinfizierter Zellen und Tumorzellen, gezielt auszulösen. Ihre Präsenz im Blut ermöglicht es ihnen, schnell auf Infektionen zu reagieren und in verschiedene Gewebe einzudringen, wenn eine Bedrohung auftritt. Sie sind auch in verschiedenen Geweben und Organen des Körpers zu finden, insbesondere in der Milz, der Leber, den Lymphknoten und der Lunge.
Obwohl NK-Zellen nicht aktiviert werden müssen, wird ihre Aktivität durch Zytokine gesteigert. Im Gegensatz zu anderen Immunzellen besitzen sie keine spezifischen Rezeptoren für fremde Antigene. Stattdessen nutzen sie eine Reihe von Rezeptoren, die in zwei Kategorien unterteilt werden: aktivierende und inhibierende Rezeptoren.
Inhibierende Rezeptoren
Inhibierende Rezeptoren erkennen MHC-Klasse-I-Moleküle, die normalerweise auf der Oberfläche aller kernhaltigen Zellen vorhanden sind und als SELBST-Marker für das Immunsystem dienen. Die Bindung der inhibierenden Rezeptoren erfolgt unabhängig von den präsentierten Peptiden auf dem MHC-Klasse-I-Molekül; die NK-Zelle erkennt nicht direkt die Peptide, sondern das MHC-Klasse-I-Moleküls selbst.
NK-Zellen scannen die Zelloberflächen im Körper und binden ihre inhibierenden Rezeptoren an MHC-Klasse-I-Moleküle. Aufgrund der Bindung wird ein inhibierendes (negatives) Signal in die NK-Zelle gesendet. Dieses Signal unterdrückt die Aktivierung der NK-Zelle und schützt somit die gesunden Zellen vor Angriffen.
Tumorzellen und virusinfizierte Zellen reduzieren oft die Expression von MHC-Klasse-I-Molekülen, um der Erkennung durch zytotoxische T-Zellen zu entgehen. Dieses Phänomen wird als ‚missing-self‚-Prinzip bezeichnet. Wenn eine Zelle keine oder reduzierte MHC-Klasse-I-Moleküle auf ihrer Oberfläche exprimiert, wird das inhibierende (negative) Signal nicht gesendet und die Zielzelle wird angegriffen.

Aktivierende Rezeptoren
Aktivierende Rezeptoren erkennen Stressmoleküle, die auf der Oberfläche von infizierten oder transformierten Zellen exprimiert werden. Es gibt verschiedene Stressmoleküle, die zusammengefasst als ‚Stress-induced self‚ bezeichnet werden. Wenn Zellen unter Stress stehen, exprimieren sie diese Moleküle. Die aktivierenden Rezeptoren auf NK-Zellen erkennen diese Stressmoleküle, was zur Aktivierung und zum Angriff der NK-Zellen auf die betroffenen Zellen führt.

Die Aktivierung der NK-Zellen hängt von einem feinen Gleichgewicht zwischen aktivierenden und inhibierenden Signalen ab. Wenn sowohl aktivierende als auch inhibierende Signale erkannt werden, erfolgt eine Gewichtung dieser Signale. Im Falle einer überwiegenden Hemmung durch die inhibierenden Rezeptoren wird die Aktivierung der NK-Zelle unterdrückt, und die Zielzelle bleibt geschützt. Wenn jedoch die aktivierenden Signale dominieren oder die inhibierenden Signale schwächer sind, wird die NK-Zelle aktiviert und greift die Zielzelle an. Auf diese Weise können NK-Zellen ihr Ziel erkennen und töten, trotz der Bemühungen von Zielzellen, der Immunüberwachung zu entgehen.
Die Natürliche Killerzelle (NK-Zelle) kann die Zielzelle auf zwei Arten eliminieren.
1) Tötung durch Perforine und Granzyme
Zum einen setzt sie Zellgifte frei. Im Zytoplasma der NK-Zelle befinden sich zahlreiche kleine Granula, die Proteine wie Perforin und Granzyme enthalten.

Diese werden in der Umgebung der Zielzelle freigesetzt. Die Perforine bohren Löcher in die Membran der Zielzelle, durch die Granzymen eindringen und die Apoptose einleiten.
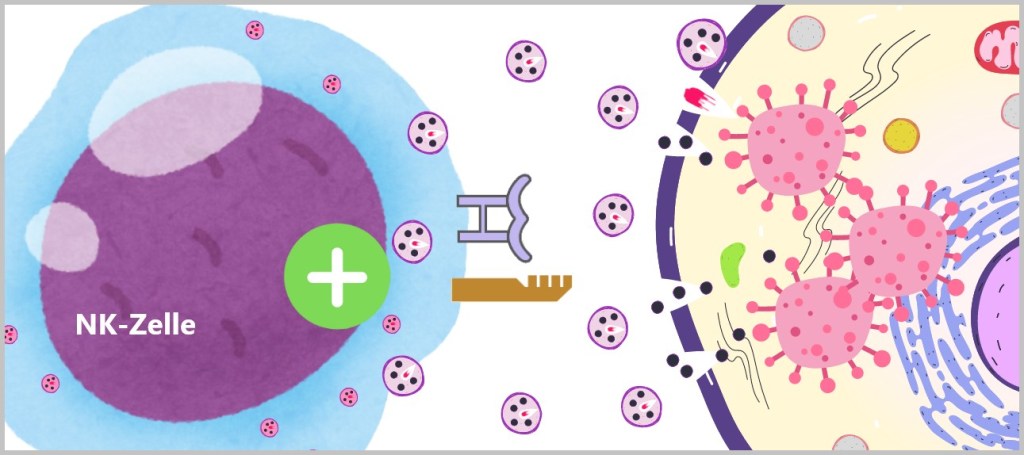
Manchmal binden Antikörper (die vom Immunsystem produziert werden) an abnormale Zellen wie virusinfizierte Zellen oder Krebszellen. NK-Zellen erkennen dabei nicht den spezifischen variablen Teil des Antikörpers, der an das Antigen gebunden ist, sondern die konstante Schwanzregion des Antikörpers, den sogenannten Fc-Teil. An dieser Stelle reicht es zu wissen, dass Antikörper aus einem variablen und einem konstanten Teil bestehen. Antikörper werden wir in späteren Kapiteln genauer betrachten. NK-Zellen besitzen Fc-Rezeptoren, die speziell an diesen konstanten Fc-Teil der Antikörper binden.
Nachdem die NK-Zelle an die Antikörper gebunden hat, setzt sie Perforine und Granzyme frei, um die Zielzelle zu zerstören.
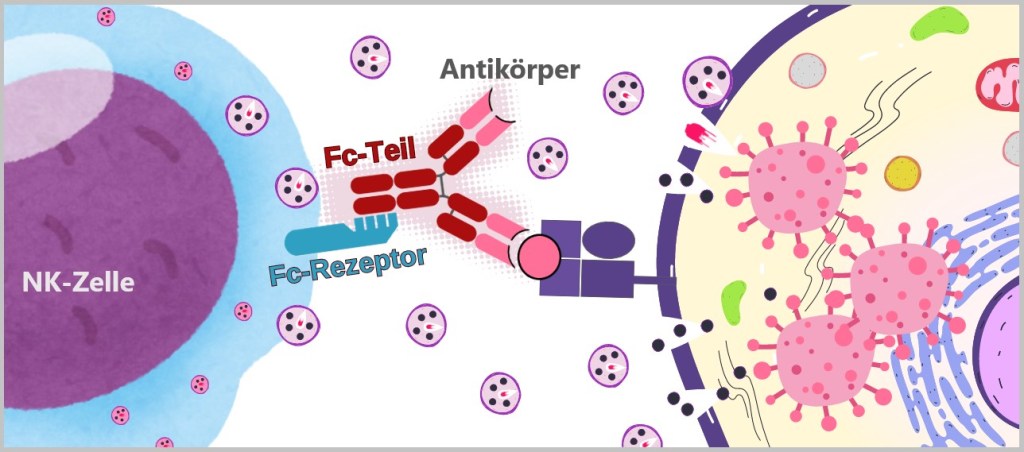
2) Tötung durch Fas-Ligand (FasL)
Tumorzellen oder infizierte Zellen können Fas-Rezeptoren exprimieren. Fas ist ein spezifischer ‚Todesrezeptor‘. NK-Zellen besitzen Fas-Liganden (FasL). Wenn die NK-Zelle mit ihrem Fas-Ligand an den Fas-Rezeptor der Zielzelle bindet, übermittelt sie der Zielzelle Signale, die den Apoptoseweg aktivieren. Der Kontakt zwischen Fas-Ligand und Fas-Rezeptor wird auch als ‚Todeskuss‘ bezeichnet.
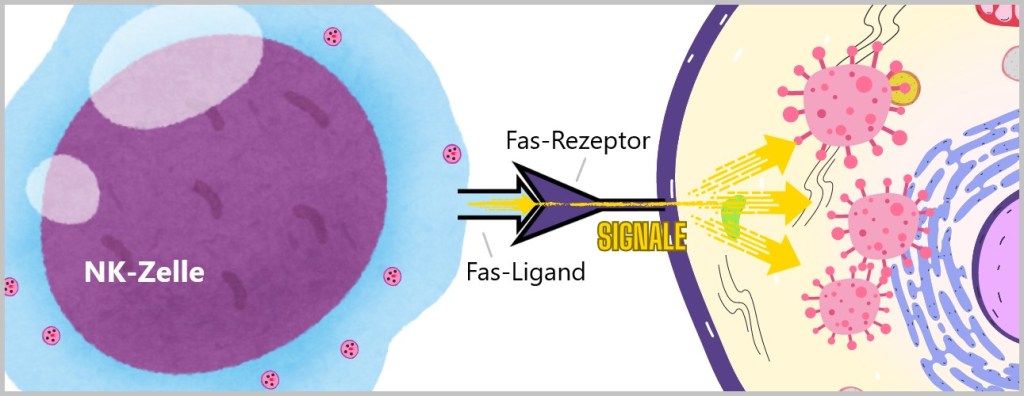
Die Zielzelle durchläuft eine Reihe geordneter Veränderungen: Zuerst schrumpft sie, und das Chromatin (das Material, aus dem die Chromosomen bestehen) verdichtet sich. Danach wird die DNA in kleine Fragmente zerlegt. Schließlich zerfällt die Zelle in kleine Bläschen, sogenannte apoptotische Körperchen, die von spezialisierten Zellen des Immunsystems, wie Makrophagen, erkannt und beseitigt werden.
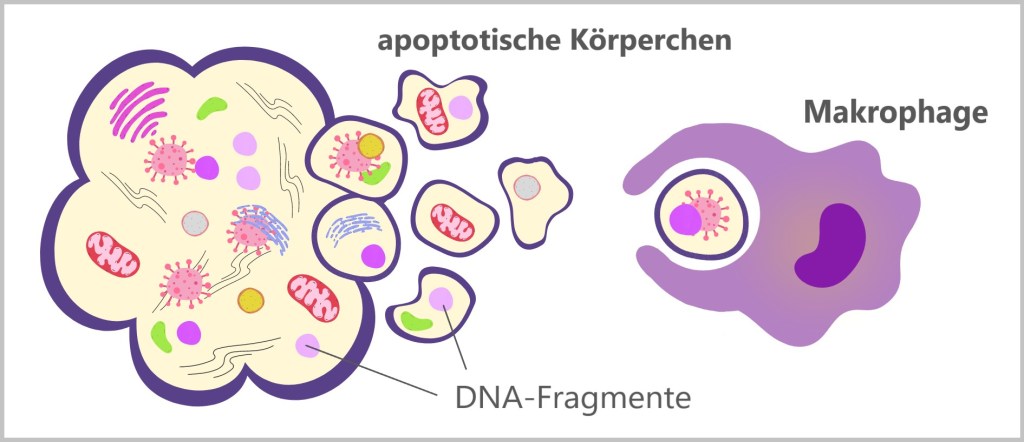
Das folgende Animationsvideo erklärt kurz und prägnant die Funktion und Bedeutung der NK-Zellen.
„In der jüngeren Vergangenheit ging man davon aus, dass NK-Zellen nicht über ein immunologisches Gedächtnis verfügen, sich also nicht an Begegnungen mit virus-infizierten Zellen ‚erinnern‘ können. Seit einigen Jahren gibt es jedoch Hinweise, dass sie sich im Laufe ihres Lebens an ihre Umgebung anpassen – Fähigkeiten, die man bisher nur dem erworbenen Immunsystem zugeordnet hat.“ [DocCheck]
Obwohl NK-Zellen zum angeborenen Immunsystem gehören, werden sie oft als Schnittstelle zwischen dem angeborenen und dem erworbenen Immunsystem betrachtet, da sie durch die Interaktion mit anderen Immunzellen die gesamte Immunreaktion beeinflussen. Natürliche Killerzellen spielen eine entscheidende Rolle bei der Bekämpfung von Virusinfektionen und Krebszellen und halten diese Bedrohungen in Schach, bis die spezifische Immunabwehr vollständig aktiviert ist.
Die Leukozyten (weißen Blutkörperchen) als zweite Verteidigungslinie werden bei ihrer Arbeit durch das Komplementsystem unterstützt.
5.4. Das Komplementsystem
Ein wichtiger Teil unserer Immunantwort ist das Komplementsystem. Es ist bereits bei Neugeborenen vorhanden und gehört somit zum angeborenen Immunsystem. Als Sofortmaßnahme richtet es sich gegen Eindringlinge, die die natürlichen Körperbarrieren, also Haut oder Schleimhaut, überwunden haben. Im Zusammenspiel mit dem spezifischen Immunsystem „komplementiert“ es die Immunantwort.
Im Wesentlichen hat das Komplementsystem drei Aufgaben: es markiert Feinde, aktiviert die Immunabwehr und brennt Löcher in die Feinde, bis sie sterben.
Um Pathogene wieder loszuwerden, durchläuft das Komplementsystem folgende Phasen:
a) Erkennen und Markieren des Pathogens (Opsonierung)
b) Aktivierung der Immunabwehr (Entzündung, Komplement-Kaskade)
c) Zerstörung des Pathogens (Phagozytose, Lyse)
d) Beseitigung der Überreste und Heilung des geschädigten Gewebes
Für diese Aufgaben stehen etwa 30 Komplement-Proteine zur Verfügung, die in den Körperflüssigkeiten und im Gewebe vorhanden sind. Diese Proteine haben unterschiedliche Funktionen und werden Komplementfaktoren (C1, C2, C3, … C9) genannt. Sie sind in der Lage, sich in weitere Untereinheiten zu spalten (z.B. aus C3 wird C3a und C3b). Mit der Spaltung werden sie aktiviert.
a) Erkennen und Markieren des Pathogens
Pathogene werden an sich wiederholenden Mustern auf ihrer Oberfläche erkannt, die nur auf körperfremden Mikroorganismen oder kranken Zellen vorhanden sind. Auf der Suche nach krankmachenden Veränderungen patrouillieren Komplement-Proteine unentwegt durch Blut, Gewebe und Schleimhaut. Sobald sie auf etwas Fremdes stoßen, das sie als pathogen erkennen, heften sie sich an das Fundstück und markieren es damit für das Immunsystem als FREMD.
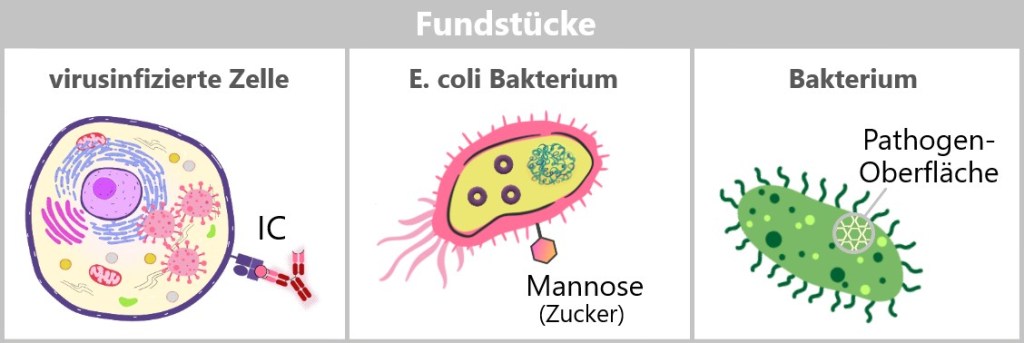
Das Fundstück kann zum Beispiel ein Antigen-Antikörper-Komplex, auch Immunkomplex (IC) genannt, sein, bei dem ein Antikörper an ein Antigen gebunden hat.

Oder sie heften sich an die Oberflächen von Bakterien, Viren und anderen Parasiten. Diesen Prozess nennt man Opsonierung. Die so markierten Pathogene sind nun besser für andere Immunzellen wie Makrophagen, dendritische Zellen, Granulozyten und natürliche Killerzellen sichtbar und greifbar. Je nachdem, wie die Opsonierung erfolgt, unterscheidet man drei verschiedene Komplementwege.
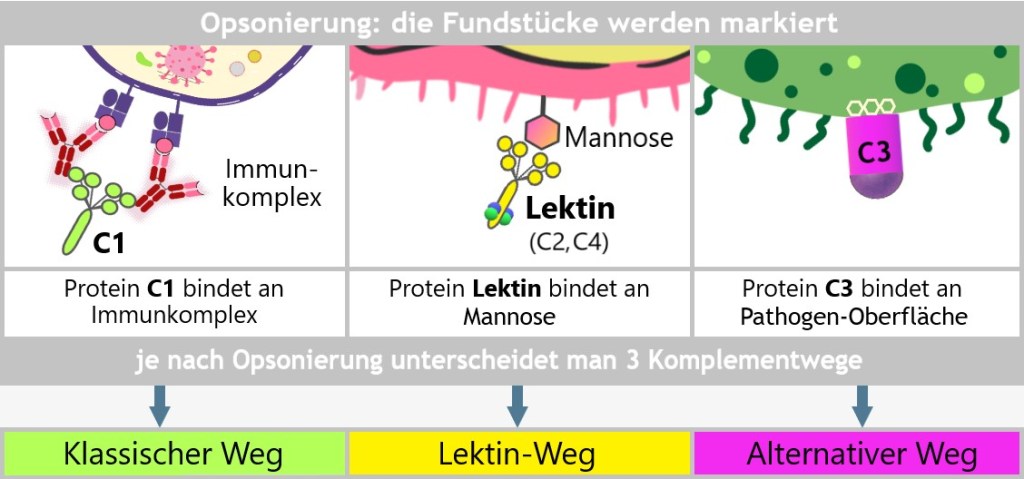
b) Aktivierung der Immunabwehr
Je nach Aktivierungsweg binden unterschiedliche Proteine an das Pathogen (siehe obige Abbildung). Im klassischen Weg bindet C1 an Antigen-Antikörper-Komplexe (Immunkomplexe), im Lektin-Weg bindet Mannose-bindendes Lektin (MBL) an Zuckerstrukturen (Mannose) auf der Pathogenoberfläche, und im alternativen Weg bindet C3 direkt an die Pathogenoberfläche. Diese Bindungen führen alle zur Bildung der C3-Konvertase, einem speziellen Enzym, dass das Protein C3 in zwei Teile aufspaltet: C3a und C3b.
Da dieser Mechanismus komplex ist, wird hier nur kurz erwähnt, dass es im klassischen Weg und im Lektin-Weg nach der Bindung der entsprechenden Proteine zu einer Reihe von Reaktionen kommt, die letztlich zur Bildung der C3-Konvertase führen. Im alternativen Weg bildet sich C3-Konvertase direkt aus. C3b, das Produkt dieser Spaltung, heftet sich dann an die Oberfläche des Pathogens. Im alternativen Weg verbleibt C3b direkt an der Pathogenoberfläche.
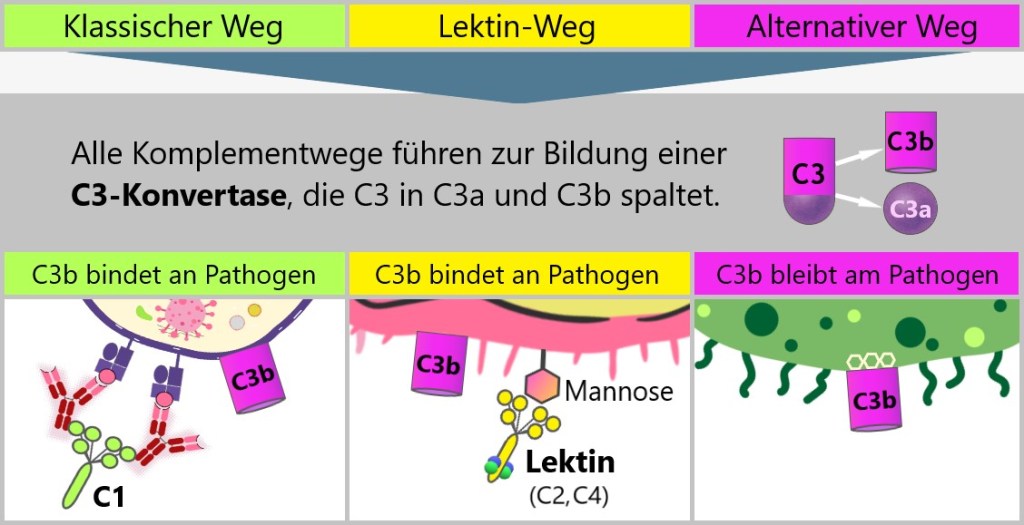
Die kleineren C3a-Proteine wirken als Notsignale, die weggespült werden und dabei weitere Komplement-Proteine aktivieren. Diese neu mobilisierten Proteine folgen den Notsignalen zum Ursprung der Entzündung, heften sich an den Feind und spalten sich ebenfalls. Dies führt zu einem Domino-Effekt, der als Komplement-Kaskade bezeichnet wird. Eine Entzündungsreaktion wird ausgelöst, die sich immer weiter verstärkt, bis unzählige Komplement-Proteine die Eindringlinge bedecken.
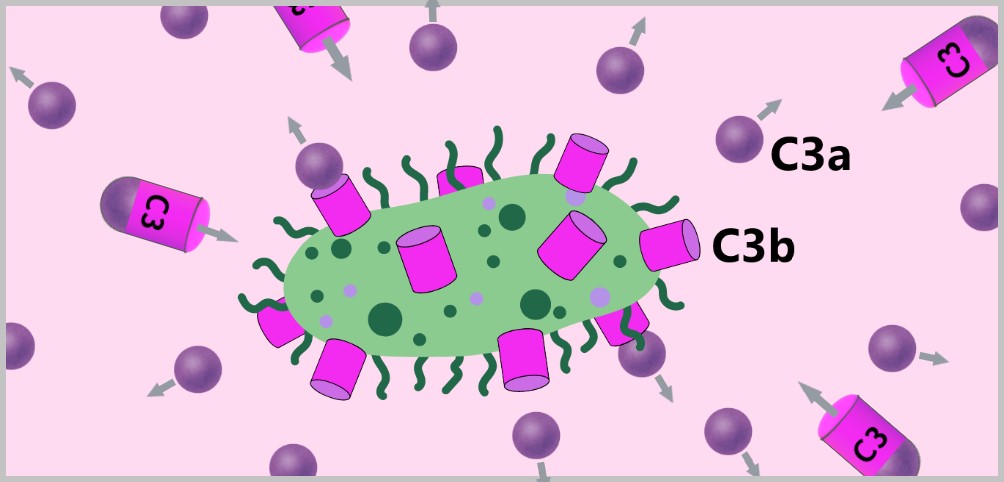
Die Notsignale bewirken außerdem, dass sich die lokalen kleineren Blutgefäße weiten und durchlässiger werden. Dadurch können Immunzellen leichter aus den Blutgefäßen in das infizierte Gewebe einwandern. Zusätzlich werden durch die Notsignale auch weitere Immunzellen angelockt. Dies führt zu einer Schwellung der Umgebung am Infektionsort, wodurch die typischen Merkmale einer Entzündung wie Schwellung, Rötung, Wärme und Schmerz entstehen. Die Entzündung brennt.

c) Zerstörung des Pathogens
Die herbeigerufenen Immunzellen finden die markierten Erreger, indem sie spezielle Komplementrezeptoren auf ihrer Oberfläche nutzen, die an das C3b-Protein binden. Diese Rezeptoren ermöglichen es den Phagozyten, die markierten Pathogene gezielt zu erkennen. Anschließend umhüllen die Fresszellen (Phagozyten) das Pathogen, nehmen es in sich auf und verdauen es.

Auch die Komplement-Proteine gehen zum Angriff über. Am Eindringling binden nun weitere Proteine (C5b, C6, C7, C8 und mehrere C9). Diese Komplement-Proteine formieren sich zu Protein-Einheiten (C5b678poly9-Komplexen), sogenannten Membranangriffskomplexen (MAC), und diese stanzen Poren in die Zellmembran des Feindes. Die so erzeugten Löcher in der Zellmembran führen zum Flüssigkeitsaustausch zwischen Zellinnerem und Umgebung, was zur Auflösung des Krankheitserregers führt, die sogenannte Lyse.

Die Animation „Kleine Bomben im Blut – Das Komplement-System“ stellt sehr anschaulich die beschriebenen komplexen Prozesse dar.
Das Komplementsystem steht in starker Wechselwirkung mit dem Gerinnungssystem. Die durch das Komplementsystem ausgelöste Entzündungsreaktion verursacht an der Infektionsstelle eine Blutgerinnung. Gerinnsel verschließen die kleinen Blutgefäße und verhindern so, dass sich die Krankheitserreger über das Blut weiter ausbreiten können. Gleichzeitig wird Flüssigkeit ins Gewebe und von dort zu den Lymphknoten geleitet. Die mit Antigenen beladenen dendritischen Zellen erreichen so leichter die Lymphknoten. Dort präsentieren sie die Antigene den T-Zellen und leiten somit die spezifische Immunantwort ein.
d) Beseitigung der Überreste und Heilung des geschädigten Gewebes
Die Immunantwort endet, wenn die Bedrohung beseitigt wurde. Für die Heilung müssen zunächst die Überreste von Zellschrott, Bakterien oder Viren aus dem Wundgebiet beseitigt werden. Diese Aufgabe übernehmen die Makrophagen. Durch die Reinigung löst sich die Entzündung auf. Mit der Bildung neuer Zellen wird das Gewebe repariert oder vollständig regeneriert. Die überflüssig gewordenen Gerinnsel werden durch Fibrinolyse, also die enzymatische Auflösung von Gerinnseln, wieder abgebaut.
Regulierung des Komplementsystems
Die verschiedenen Komplement-Fragmente haben auch eine immunregulierende Wirkung. Diese Regulatoren können die Abwehrreaktion verstärken oder hemmen und somit die Immunantwort beenden. Eine Fehlregulierung des Komplementsystems hat schwerwiegende Folgen für die Gesundheit. Sowohl das Komplement- als auch das Gerinnungssystem sollen nur lokal wirken. Die Ausbreitung auf den gesamten Organismus hätte schwerwiegende Folgen. Eine Fehlregulierung kann zu Autoimmunität führen, bei der körpereigene Zellen angegriffen werden und verschiedene Krankheiten entstehen.
Durch die Kombination von Leukozyten und dem Komplementsystem wird eine effektive und koordinierte Abwehr gegen Infektionen gewährleistet. Schaffen es die spezialisierten Immunzellen in Zusammenarbeit mit dem Komplementsystem, alle Erreger zu eliminieren, so endet hier die Immunantwort. Jedoch gelingt es nicht immer, alle Pathogene durch die unspezifische Abwehr vollständig zu beseitigen. In solchen Fällen tritt das spezifische Immunsystem in Aktion.
5.5. Die spezifische Immunabwehr
Obwohl die angeborene, unspezifische Abwehr sehr schnell reagiert, ist sie jedoch nicht immer ausreichend. Sie kann viele Krankheitserreger abwehren, aber einige sind in der Lage, diese Verteidigungslinie zu überwinden. Ab diesem Zeitpunkt reagiert der Körper mit einer gezielten, also spezifischen Immunantwort. Die spezifische Abwehr ist langsamer als die Unspezifische, da sie Zeit benötigt, um eine maßgeschneiderte Antwort auf den Eindringling zu entwickeln.
Da sich diese Abwehr gezielt gegen bestimmte Krankheitserreger richtet, hat sie eine wesentlich höhere Treffsicherheit und Effizienz. Zudem kann sie sich Informationen über einen Angreifer merken. Sie entwickelt sich in einem lebenslangen Trainingsprozess. Daher bezeichnet man sie auch als erworbene Immunabwehr oder adaptive Immunabwehr.
5.5.1. Schlüsselspieler der adaptiven Immunantwort
5.5.2. Naive B- und T-Zellen: Die Vielfalt der Immunantwort
5.5.3. Die Rolle der antigenpräsentierenden Zellen (APCs)
5.5.4. Die Bedeutung der Lymphknoten für die adaptive Immunantwort
5.5.5. Erkennungsphase
5.5.6. Aktivierungsphase
5.5.7. Effektorphase
III – Dritte Verteidigungslinie: die Antikörper
5.5.8. Arten von Antikörpern
5.5.9. Die Wirkungsphase der Antikörper
5.5.10. Regulatorische T-Zellen und ihre Rolle im Immunsystem
5.5.11. Abschaltphase
5.5.12. Gedächtnisphase
5.5.1. Schlüsselspieler der adaptiven Immunantwort
Schlüsselspieler der adaptiven Immunantwort sind spezialisierte Leukozyten, die B-Lymphozyten (B-Zellen) und T-Lymphozyten (T-Zellen). Diese arbeiten in zwei eng miteinander verflochtenen Systemen: der humoralen und der zellulären Immunantwort.
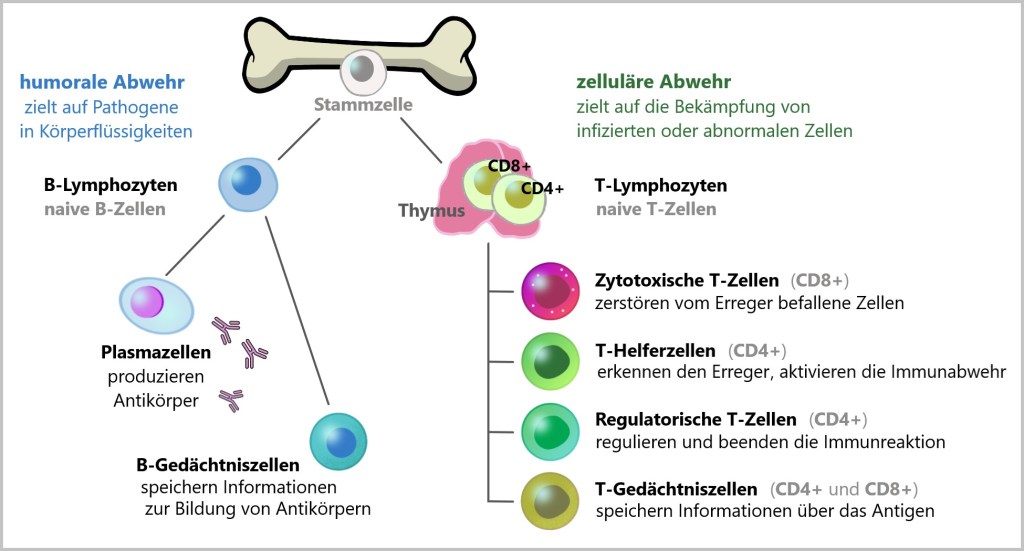
a) Entwicklung und Reifung der Lymphozyten
b) Humorale und Zelluläre Abwehrmechanismen
c) Migration und Verteilung der Lymphozyten
d) Struktur der lymphatischen Organe
a) Entwicklung und Reifung der Lymphozyten
B- und T-Zellen entstehen aus Stammzellen im Knochenmark. Während die B-Zellen im Knochenmark vollständig ausreifen, wandern die T-Zellen nach ihrer Bildung in den Thymus, um dort ihre Reifung abzuschließen. Die Kürzel B und T leiten sich von ihren Bildungsorten ab: B steht für Bone Marrow (Knochenmark), und T steht für Thymus.
B- und T-Zellen gelten als naiv, solange sie noch keinem Antigen begegnet sind.
b) Humorale und Zelluläre Abwehrmechanismen
Bei der humoralen Abwehr handelt es sich um die Bekämpfung von Krankheitserregern in den Körperflüssigkeiten wie Blut und Lymphe (lat. humor bedeutet Flüssigkeit). Die Hauptakteure dieser Abwehr sind die B-Lymphozyten. Sie erkennen spezifische Antigene und produzieren daraufhin Antikörper, die sich an die Antigene binden. Diese Bindung markiert die Krankheitserreger für die Vernichtung durch andere Immunzellen oder neutralisiert sie direkt. Dieser Prozess ist besonders effektiv gegen Pathogene, die sich außerhalb der Körperzellen befinden, wie Bakterien und Viren, die noch nicht in eine Zelle eingedrungen sind.
Die zelluläre Abwehr hingegen wird von den T-Lymphozyten ausgeführt. Sie erkennen und zerstören infizierte oder auf andere Weise abnormal gewordene Zellen. T-Lymphozyten können auch weitere Immunzellen aktivieren, um die Vernichtung von Pathogenen zu erhöhen. T-Zellen werden weiter in CD4+ T-Zellen und CD8+ T-Zellen unterteilt, die jeweils unterschiedliche Rollen in der Immunantwort haben.
Im weiteren Verlauf des Textes werden die Begriffe CD4-T-Zellen und CD8-T-Zellen verwendet, um die Lesbarkeit zu verbessern. Das ‚+‘-Symbol bezeichnet den Ausdruck von spezifischen Oberflächenmarkern auf den T-Zellen. Es zeigt an, dass diese T-Zellen die entsprechenden Marker auf ihrer Oberfläche tragen. In vielen Kontexten kann das ‚+‘-Symbol weggelassen werden, ohne dass die Bedeutung verloren geht.
CD4-T-Zellen sind hauptsächlich T-Helferzellen, sie unterstützen und regulieren die Aktivitäten anderer Immunzellen. CD8-T-Zellen sind hauptsächlich zytotoxische T-Zellen. Sie erkennen und zerstören infizierte Zellen, insbesondere solche, die von Viren befallen sind, sowie Krebszellen.
c) Migration und Verteilung der Lymphozyten
Nach ihrer Entwicklung gelangen die naiven B-Zellen und T-Zellen ins Blut. Sobald sie ein sekundäres lymphatisches Organ (zum Beispiel einen Lymphknoten) erreichen, verlassen sie das Blut und wandern durch das Lymphgewebe. Von dort aus kehren sie über die Lymphgefäße wieder ins Blut zurück und pendeln so zwischen Blut und sekundärem Lymphgewebe hin und her.
Um das besser zu verstehen, lohnt sich ein genauerer Blick auf den Aufbau der lymphatischen Organe.
d) Struktur der lymphatischen Organe
Die verschiedenen sekundären lymphatischen Organe (wie Lymphknoten, Milz usw.) sind alle nach einem ähnlichen Schema aufgebaut: Sie enthalten voneinander getrennte Bereiche, in denen sich die B- und T-Zellen ansammeln – die sogenannten B-Zell- und T-Zell-Zonen. Zirkulierende T- und B-Zellen gelangen vom Blut aus über einen gemeinsamen Weg in die sekundären lymphatischen Gewebe, werden jedoch dort durch die Wirkung unterschiedlicher Chemokine (Signalproteine, die die Bewegung von Zellen steuern) in ihre jeweiligen Kompartimente (Bereiche) geleitet.
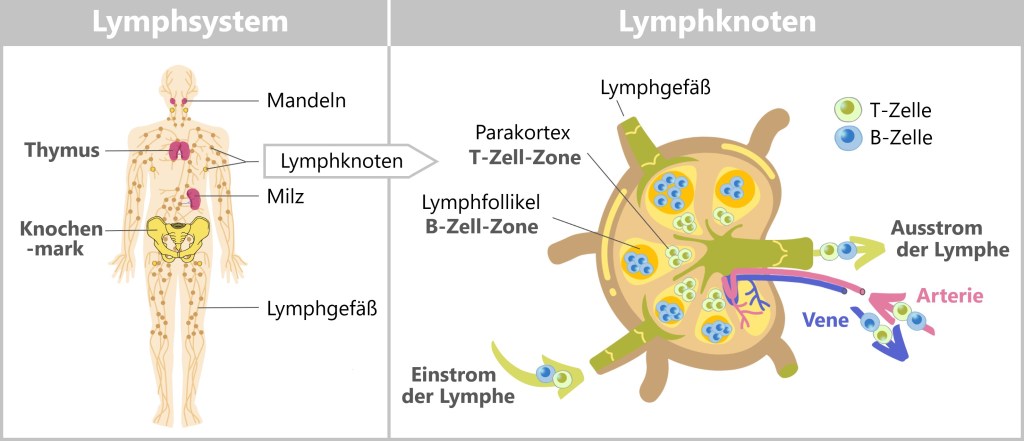
Ein Lymphknoten ist von einer dünnen Hülle aus Bindegewebe (Kapsel) umgeben, die kleine Trennwände ins Innere zieht und den Lymphknoten in verschiedene Abschnitte unterteilt. Auf der gewölbten Seite fließt die Lymphflüssigkeit über zuführende Lymphgefäße in den Lymphknoten. Auf der eingedrückten Seite, dem sogenannten Hilum, verlässt die gefilterte Lymphflüssigkeit den Lymphknoten durch ein spezielles abführendes Lymphgefäß. An dieser Stelle treten auch die Blutgefäße in den Lymphknoten ein und aus. Im Inneren durchläuft die Lymphflüssigkeit spezielle Kanäle, das sogenannte Sinussystem. In der äußeren Schicht des Lymphknotens befinden sich B-Zellen in kleinen Ansammlungen, den sogenannten Lymphfollikeln. Diese B-Zell-Region grenzt direkt an den Bereich der T-Zellen, den Parakortex. Sowohl B- als auch T-Zellen können über das Blut (Arterie) oder die zuführenden Lymphgefäße in den Lymphknoten eintreten und ihn dann entweder über das Blut (Vene) oder die abführenden Lymphgefäße wieder verlassen.
Das Lymphsystem
Das Lymphsystem ist ein wesentlicher Bestandteil unseres Immunsystems und besteht aus einem Netzwerk von Lymphgefäßen und Lymphknoten, das den gesamten Körper durchzieht. Im Gegensatz zum Blutgefäßsystem ist es nicht geschlossen. Die Lymphe, eine klare, leicht gelbliche Flüssigkeit, besteht aus Wasser, Proteinen, Fetten und weißen Blutkörperchen.
Körperzellen benötigen Nährstoffe und Sauerstoff, um ihre vielfältigen Funktionen auszuführen, und müssen gleichzeitig Stoffwechselabfälle entsorgen. Arterien liefern frisches Blut, während Venen das verbrauchte Blut und schädliche Stoffe abtransportieren. Die Lymphe (lateinisch für ‚klares Wasser‘) dient als Vermittler zwischen Blut und Körperzellen. Sie tritt aus den Kapillaren, den dünnsten Blutgefäßen, in den Raum zwischen den Zellen aus und fließt dort frei, wobei sie Stoffwechselprodukte, Fette, Zelltrümmer und Krankheitserreger aufnimmt.
Die Lymphe sammelt sich zunächst in feinen Gefäßen und fließt dann in größere Lymphbahnen. Schließlich mündet sie in die beiden Hauptvenenäste an der Basis des Halses. Auf ihrem Weg dorthin passiert die Lymphe zahlreiche Lymphknoten, die entlang der Lymphgefäße verteilt sind. Die Lymphknoten wirken wie Filterstationen, die die Lymphe reinigen, indem sie Krankheitserreger abfangen.
Lymphknoten sind kleine, bohnenförmige Strukturen, die in der Regel zwischen wenigen Millimetern und etwa 1 cm groß sind. Ein gesunder Erwachsener besitzt etwa 600 bis 700 Lymphknoten, die über den ganzen Körper verteilt sind. Sie filtern nicht nur überschüssige Flüssigkeit aus dem Gewebe, sondern aktivieren das Immunsystem, sobald Krankheitserreger erkannt werden, um die Abwehrreaktion einzuleiten und den Körper gesund zu halten.
Primäre lymphatische Organe sind das Knochenmark und der Thymus. In diesen Organen werden Lymphozyten (B-Zellen und T-Zellen) aus Stammzellen gebildet.
Zu den sekundären lymphatischen Organen zählen die Lymphknoten, die Lymphgefäße, die Milz und die Lymphfollikel der Schleimhäute. Diese Organe wirken als Filterstationen und entfernen abgestorbene Zellen, Fremdmaterial und Proteinaggregate aus dem Kreislauf. In ihnen sind Lymphozyten, Monozyten und dendritische Zellen sehr mobil und können sich in das lymphatische Gewebe hinein- und hinausbewegen.
5.5.2. Naive B- und T-Zellen: Die Vielfalt der Immunantwort
Naive T-Zellen tragen auf ihrer Oberfläche einzigartige T-Zell-Rezeptoren (TCRs), die speziell für die Erkennung von Antigenen entwickelt sind. Ebenso besitzen naive B-Zellen eine Vielzahl von B-Zell-Rezeptoren (BCRs), die ebenfalls zur Antigenerkennung dienen.
Die immense Vielfalt der TCRs und BCRs entsteht durch einen genetischen Mechanismus, der als somatische Rekombination oder somatische V(D)J-Rekombination bekannt ist. Bei diesem Prozess werden verschiedene Gensegmente zufällig neu kombiniert, was zur Bildung von Milliarden verschiedener Rezeptoren führt. Dies ermöglicht dem Immunsystem, auf nahezu jedes erdenkliche Antigen vorbereitet zu sein.
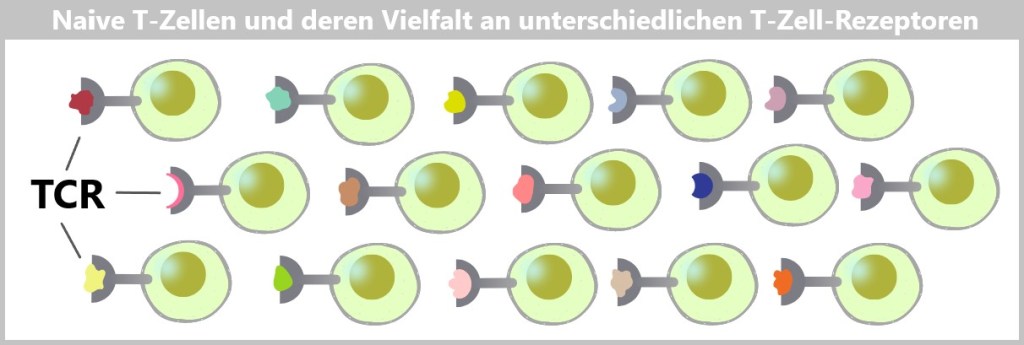
Was ist die somatische V(D)J-Rekombination?
Unser Immunsystem muss in der Lage sein, Millionen von unterschiedlichen Erregern wie Viren und Bakterien zu erkennen. Damit das möglich ist, brauchen wir eine riesige Anzahl von verschiedenen „Erkennungswerkzeugen“: Antikörpern und T-Zell-Rezeptoren. Diese Werkzeuge sind spezielle Proteine, die genau zu einem bestimmten Erreger passen müssen, ähnlich wie ein Schlüssel zu einem Schloss. Aber unser Erbgut (DNA) ist begrenzt – wie also kann der Körper so viele verschiedene Erkennungswerkzeuge herstellen?
Die Lösung liegt in einem cleveren Mechanismus namens somatische V(D)J-Rekombination. Dieser Mechanismus funktioniert wie ein Baukasten:
Gene als Bauplan: Antikörper und T-Zell-Rezeptoren bestehen aus verschiedenen Bausteinen, die von bestimmten Genabschnitten kodiert werden. Diese Abschnitte nennt man V (Variable), D (Diversity) und J (Joining). Jeder dieser Abschnitte gibt einen Teil des Antikörpers oder T-Zell-Rezeptors vor.
Mix and Match: In den Vorläuferzellen der B- und T-Zellen findet die somatische V(D)J-Rekombination statt. Hierbei werden einzelne V-, D- und J-Abschnitte zufällig miteinander kombiniert, um einen einzigartigen Bauplan für einen Antikörper oder T-Zell-Rezeptor zu erstellen. Dadurch entstehen Millionen von verschiedenen Kombinationen – jede Kombination entspricht einem einzigartigen Antikörper oder Rezeptor.
Zufällige Vielfalt: Der Prozess der Rekombination ist so gestaltet, dass er jede Menge Vielfalt schafft. Selbst winzige Änderungen in den kombinierten Abschnitten führen zu einem anderen Antikörper oder Rezeptor. So kann das Immunsystem auf praktisch jeden erdenklichen Krankheitserreger vorbereitet sein.
Warum ist das wichtig?
Durch die somatische V(D)J-Rekombination kann das Immunsystem eine unglaublich breite Palette an Antikörpern und T-Zell-Rezeptoren produzieren, ohne dass jedes einzelne dieser „Erkennungswerkzeuge“ in unserer DNA gespeichert sein muss. Das bedeutet, dass unser Immunsystem flexibel und anpassungsfähig ist und auch auf neue oder unbekannte Krankheitserreger reagieren kann.
Zusammenfassung
Die somatische V(D)J-Rekombination ist wie ein riesiger Baukasten, der es dem Immunsystem ermöglicht, Millionen von verschiedenen „Schlüsseln“ (Antikörper und T-Zell-Rezeptoren) herzustellen. Jeder Schlüssel ist einzigartig und kann einen spezifischen Krankheitserreger erkennen und bekämpfen. Dadurch kann unser Körper effektiv auf eine Vielzahl von Bedrohungen reagieren, selbst wenn wir diesen Erregern noch nie zuvor begegnet sind.
Detaillierte Informationen zu diesem komplexen Thema findest du in den folgenden Quellen:
„So geht’s: Ein T-Zell-Rezeptor (die einfachere Version)“
„TCR gene rearrangements“
Bereits ab der Geburt verfügt der Mensch über mindestens eine Immunzelle für jeden potenziellen Erreger auf diesem Planeten.
[Evolution der Immunrezeptor-Vielfalt]
Oder, wie es in den Videos „Das Immunsystem erklärt“ und „Diese Zellen machen dich immun gegen ALLES“ eindrucksvoll beschrieben wird: „Dein Immunsystem hat eine perfekte Waffe gegen jede einzelne mögliche Krankheit im Universum. Gegen die Pest, das Coronavirus – oder eine Infektion, die erst in 100 Jahren auf dem Mars entstehen wird.“
Die Videos wurde im Kanal ‚Dinge Erklärt – Kurzgesagt‘ 2021 veröffentlicht, der bis Ende 2022 Teil des Netzwerkes funk von ARD und ZDF war. [wikipedia]
Diese Diversität verleiht dem adaptiven Immunsystem seine beeindruckende Stärke, indem es eine riesige Bibliothek von Antworten auf praktisch jeden möglichen Erreger bereithält. Diese enorme Anpassungsfähigkeit ist entscheidend, um gegen die rasch evolutionierenden Bakterien und Viren bestehen zu können.
Trotz seiner erstaunlichen Vielfalt stößt auch unser Immunsystem an Grenzen.
Ein anschauliches Beispiel dafür ist die Pest im Mittelalter. Das Bakterium Yersinia pestis, das die Krankheit auslöste, stellte eine neuartige und tödliche Bedrohung dar. Die Infektion breitete sich so schnell aus, dass das Immunsystem der Betroffenen oft nicht rechtzeitig eine wirksame Abwehr aufbauen konnte, bevor die Krankheit tödlich verlief.
Individuelle Unterschiede in der Immunantwort beruhen auf einer Vielzahl genetischer Faktoren. Nicht jeder Mensch verfügt über die gleiche Fähigkeit, auf Infektionen zu reagieren, was erklärt, warum manche Menschen Krankheitserreger besser abwehren können als andere. Ein wichtiger Faktor hierbei ist die Vielfalt der MHC-Moleküle, die die Erkennung und Präsentation von Krankheitserregern steuern. Menschen mit unterschiedlichen MHC-Varianten können unterschiedlich gut auf Infektionen reagieren. Während einige gegen bestimmte Erreger extrem anfällig sind, gibt es immer Menschen, die dank ihrer genetischen Ausstattung besser mit neuen Bedrohungen umgehen können. Diese genetische Vielfalt war einer der Gründe, warum nicht alle Menschen während der Pestepidemie starben – einige hatten von Natur aus stärkere Abwehrmechanismen.
Zusätzlich beeinflussen Faktoren wie Alter, Vorerkrankungen und der allgemeine Gesundheitszustand die Leistungsfähigkeit des Immunsystems. Wenn das Immunsystem geschwächt oder überlastet ist, kann es selbst mit all seiner Komplexität und Anpassungsfähigkeit möglicherweise nicht schnell genug reagieren, um eine tödliche Infektion zu stoppen. Letztlich ist das Immunsystem ein beeindruckendes Schutzsystem, das uns gegen unzählige Bedrohungen verteidigt. Doch auch hier gibt es Grenzen, die uns daran erinnern, dass Genetik, Umweltfaktoren und das Zufallsprinzip darüber entscheiden können, wer eine Infektion überlebt – und wer nicht.
Alle Lebewesen bestehen hauptsächlich aus Proteinen, die wie 3D-Puzzleteile aufgebaut sind und Milliarden verschiedene Formen annehmen können. Krankheitserreger nutzen diese Vielfalt, um ihre Strukturen ständig zu verändern. Das Influenzavirus zum Beispiel mutiert so schnell, dass seine Hüllproteine ständig leicht verändert sind, was es dem Immunsystem erschwert, es zu erkennen.
Das angeborene Immunsystem kennt eine Vielzahl der häufigsten Proteinpuzzleteile und fungiert daher als Allzweckwaffe. Allerdings ist es gegen die unzähligen Mutationen und Anpassungen der Erreger oft machtlos. Hier kommt das adaptive Immunsystem ins Spiel, das in der Lage ist, zwischen einer und zehn Milliarden verschiedener feindlicher Proteinpuzzleteile zu unterscheiden.
Damit diese hochspezialisierten Zellen jedoch effektiv gegen einen spezifischen Erreger vorgehen können, müssen sie zuerst das entsprechende Antigen präsentiert bekommen. Genau hier spielen die antigenpräsentierenden Zellen (APCs) eine entscheidende Rolle.
5.5.3. Die Rolle der antigenpräsentierenden Zellen (APCs)
Die Schnittstelle zwischen der angeborenen und adaptiven Immunabwehr bilden die antigenpräsentierenden Zellen (APCs). Zu den bekanntesten APCs gehören Makrophagen, dendritische Zellen und B-Zellen, wobei dendritische Zellen besonders effizient in der Aufnahme und Präsentation von Antigenen sind. Die Antigenpräsentation ist eine wesentliche Voraussetzung für die Einleitung der adaptiven Immunantwort, insbesondere für die Aktivierung der T-Zellen, die meist in den Lymphknoten stattfindet. In den Lymphknoten treffen antigenpräsentierende Zellen und T-Zellen aufeinander, was die Immunantwort ermöglicht.
Dendritische Zellen haben die einzigartige Fähigkeit, Antigene auf zwei verschiedene Weisen zu präsentieren: über MHC-Klasse-II-Moleküle und über MHC-Klasse-I-Moleküle. Diese beiden Präsentationswege schauen wir uns genauer an.
a) Antigenpräsentation über MHC-II-Moleküle
b) Antigenpräsentation über MHC-I-Moleküle
c) Dendritische Zellen wandern zu den Lymphknoten
a) Antigenpräsentation über MHC-II-Moleküle
Sobald eine dendritische Zelle einen (exogenen) Erreger erkannt hat, bindet sie an ihn, umschließt ihn mit ihrer beweglichen Membran und nimmt den Erreger durch Einstülpen in sich auf.
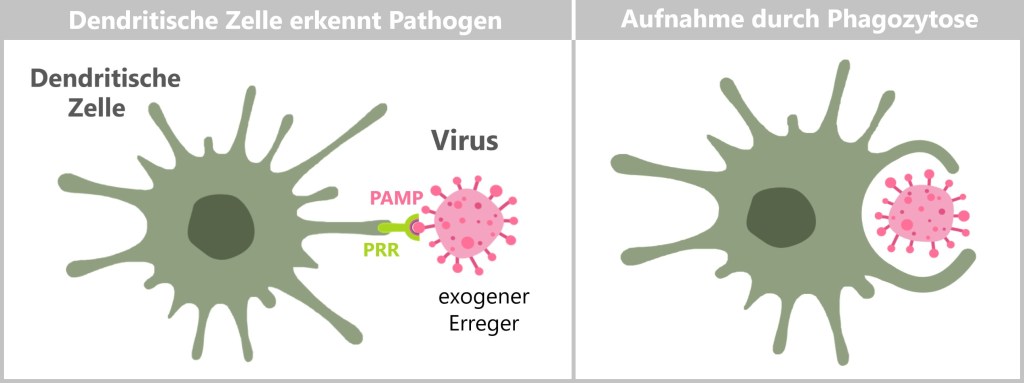
Der Erreger landet in einem membranumhüllten Bläschen, das als Phagosom bezeichnet wird. Das Phagosom fusioniert mit einem Lysosom, welches Verdauungsenzyme enthält, wodurch der Erreger abgebaut wird. Im Phagolysosom entstehen kleinere Fragmente, darunter auch potenzielle Antigene. Diese Antigene werden an MHC-Klasse-II-Moleküle gebunden und auf der Zelloberfläche präsentiert.

1) Phagozytose von exogenen Antigenen. 2) Abbau der Antigene in Phagolysosomen. 3) Zusammenbau und Transport von MHC-II-Molekülen aus dem endoplasmatische Retikulum (ER) zum Golgi-Apparat. 4) Fusion der Vesikel und Beladung der MHC-II-Moleküle mit Peptiden. 5) Präsentation des beladenen MHC-II an der Zelloberfläche.
Auf diese Weise zeigt die dendritische Zelle nach außen, welchen Erreger sie entdeckt hat. Diese MHC-II-Antigen-Komplexe sind entscheidend für die Aktivierung der CD4-T-Zellen.

Eine anschauliche kurze Visualisierung der MHC-Klasse-II-Antigenverarbeitung und -präsentation bietet Dr. Noel Kowal an.
b) Antigenpräsentation über MHC-I-Moleküle
I – Direkte Infektion
Dendritische Zellen, wie alle Zellen, müssen kontinuierlich Proteine herstellen, um zu überleben. Diese Proteine werden nach Erfüllung ihrer Funktion im Proteasom in kleinere Fragmente (Peptide) abgebaut. Wird die dendritische Zelle von einem Erreger wie einem Virus infiziert, produziert sie virale (endogene) Proteine, die ebenfalls im Proteasom abgebaut werden. Die entstehenden Peptide (Antigene) werden an die MHC-Klasse-I-Moleküle gebunden und anschließend über den Golgi-Apparat in Vesikeln zur Zellmembran transportiert. Dort stehen sie für die Erkennung durch CD8-T-Zellen bereit.

1) Die dendritische Zelle wird von einem Erreger (Virus) infiziert. 2) Der Virus wird im Proteasom in Peptide zerlegt. 3) Diese Peptide werden in das endoplasmatische Retikulum (ER) transportiert. 4) Dort binden die Peptide an MHC-Klasse-I-Moleküle. 5) Die Antigen-MHC-I-Komplexe werden über den Golgi-Apparat in Vesikel verpackt. 6) Anschließend werden sie zur Zelloberfläche transportiert. (‚endogen‘ weist darauf hin, dass der Erreger oder die Antigene von innerhalb der Zelle stammen.)
Dr. Noel Kowal stellt ebenfalls eine prägnante Visualisierung der MHC-Klasse-I-Antigenverarbeitung und -präsentation bereit.
II – Kreuzpräsentation
Interessanterweise können dendritische Zellen Antigene (von Viren oder Bakterien) auch auf MHC-Klasse-I-Molekülen präsentieren, selbst wenn sie nicht von diesen Erregern infiziert sind. Dieser Prozess heißt Kreuzpräsentation und ist wichtig für unser Immunsystem, weil er oft häufiger zur Aktivierung von Abwehrzellen führt als die direkte Infektion der dendritischen Zellen.
Dendritische Zellen nehmen dabei Antigene von toten oder zerstörten infizierten Zellen auf. Normalerweise würden diese Antigene in einem speziellen Bläschen innerhalb der Zelle, dem Phagosom, verarbeitet und auf MHC-Klasse-II-Molekülen präsentiert. Bei der Kreuzpräsentation passiert jedoch etwas Besonderes: Die Antigene gelangen aus dem Phagosom ins Zellinnere (Zytoplasma) und werden dort vom Proteasom, in kleine Stücke zerlegt.
Diese kleinen Proteinfragmente (Peptide) werden dann ins endoplasmatische Retikulum (ER) transportiert, wo sie an MHC-Klasse-I-Moleküle binden. Manchmal kann dieser Prozess sogar direkt im Phagosom stattfinden. Schließlich werden diese beladenen MHC-I-Moleküle an die Zelloberfläche gebracht.
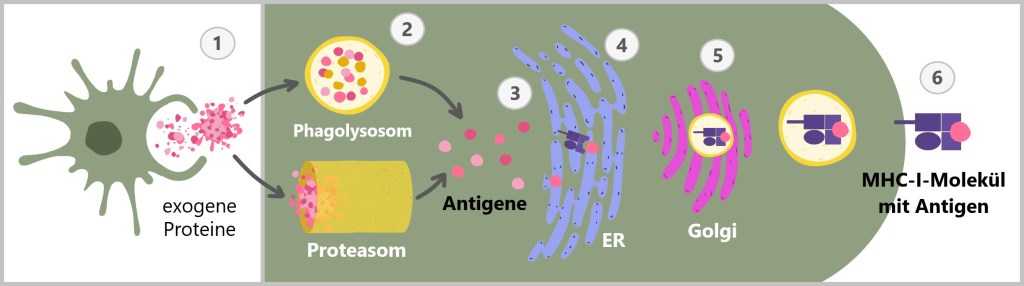
1) Die dendritische Zelle phagozytiert oder nimmt virale Reste auf, die von infizierten oder zerstörten Zellen stammen. 2) Das aufgenommene Virusmaterial wird in einem Phagosom eingeschlossen, das später mit einem Lysosom fusioniert, um ein Phagolysosom zu bilden. Das Virusmaterial kann aus dem Phagolysosom ins Zytoplasma gelangen. Oder bestimmte Virusbestandteile können direkt ins Proteasom gelangen, wo sie in kleinere Peptide zerlegt werden. 3) Diese Peptide werden in das endoplasmatische Retikulum (ER) transportiert. 4) Dort binden die Peptide an MHC-Klasse-I-Moleküle. 5) Die Antigen-MHC-I-Komplexe werden über den Golgi-Apparat in Vesikel verpackt. 6) Anschließend werden sie zur Zelloberfläche transportiert.
Auf diese Weise können dendritische Zellen Antigene, die sie eigentlich auf MHC-Klasse-II-Molekülen präsentieren würden, auch auf MHC-Klasse-I-Molekülen präsentieren. Das ist entscheidend, weil es spezielle Abwehrzellen, die CD8-T-Zellen, aktiviert, die infizierte Zellen erkennen und zerstören können.
Der Ablauf der Kreuzpräsentation bei dendritischen Zellen ist ein komplexer und noch nicht vollständig verstandener Prozess. Obwohl in den letzten Jahren erhebliche Fortschritte gemacht und viele wichtige Mechanismen aufgeklärt wurden, bleiben einige Aspekte weiterhin Gegenstand intensiver Forschung.
Die Kreuzpräsentation ist von entscheidender Bedeutung für das Immunsystem, da sie es dendritischen Zellen ermöglicht, eine Vielzahl von Antigenen darzustellen und auf diese Weise eine starke CD8-T-Zell-Antwort zu aktivieren.
Schutzmechanismen der dendritischen Zellen
Dendritische Zellen (DCs) sind wichtige Akteure im Immunsystem, die eine Brücke zwischen der angeborenen und adaptiven Immunabwehr bilden. Sie können fremde Antigene präsentieren, um T-Zellen zu aktivieren und eine spezifische Immunantwort einzuleiten. Aber wie schützen sich DCs vor Angriffen durch das eigene Immunsystem, wenn sie fremde Antigene auf MHC-I-Molekülen anzeigen?
Reifungszustand der DCs: Während DCs heranreifen, ändern sie ihre Oberfläche so, dass sie von den Immunzellen des angeborenen Immunsystems wie den natürlichen Killerzellen (NK-Zellen) nicht angegriffen werden. Reife DCs zeigen bestimmte Signale, die NK-Zellen erkennen und daraufhin keinen Angriff ausführen.
Interaktion mit NK-Zellen: Reife DCs haben auf ihrer Oberfläche Moleküle, die den NK-Zellen anzeigen, dass sie nicht feindlich sind. Diese speziellen Moleküle wirken hemmend auf die NK-Zellen. Diese Mechanismen sorgen dafür, dass die DCs sicher zu den Lymphknoten gelangen können, wo sie die T-Zellen aktivieren.
Immunmodulatorische Moleküle: DCs können Zytokine freisetzen, die die Aktivität von NK-Zellen und anderen Immunzellen dämpfen.
Schnelle Migration: DCs bewegen sich schnell vom Infektionsort zu den Lymphknoten. Diese schnelle Wanderung verringert die Zeit, in der sie möglichen Angriffen durch Immunzellen ausgesetzt sind.
Chemokine: DCs folgen speziellen chemischen Signalen, die sie auf direktem Weg zu den Lymphknoten führen. Diese Signale helfen ihnen, gefährliche Bereiche zu vermeiden, wo sie angegriffen werden könnten.
Zellinteraktionen und Umgebung: DCs arbeiten mit anderen Immunzellen zusammen, die ebenfalls helfen können, sie zu schützen. Zum Beispiel können regulatorische T-Zellen (Tregs) die Immunantwort modulieren und so verhindern, dass die DCs angegriffen werden.
Das Video „Cross-presentation of exogenous antigen“ beschreibt den Mechanismus der Kreuzpräsentation durch die dendritischen Zellen und seine Folgen.
c) Dendritische Zellen wandern zu den Lymphknoten
Nach der Antigenaufnahme und -verarbeitung wandern die dendritischen Zellen mit ihrem Fundstück zu den nächstgelegenen Lymphknoten.

Dort präsentieren sie ihre Antigen-MHC-Komplexe den naiven T-Zellen.

Die folgende grafische Darstellung zeigt noch einmal zusammengefasst, wie dendritische Zellen auf zwei verschiedene Weisen Antigene präsentieren: über MHC-Klasse-I- und MHC-Klasse-II-Moleküle.
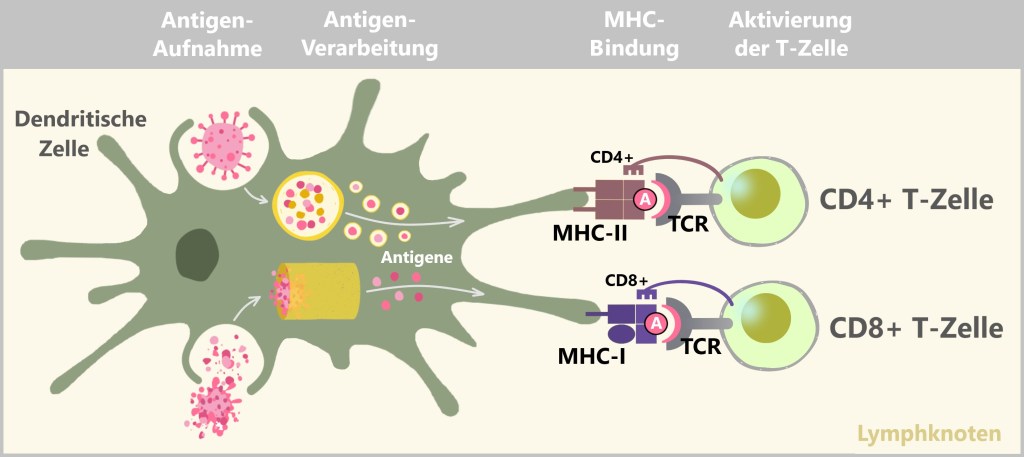
CD4-T-Zellen besitzen sowohl einen T-Zell-Rezeptor (TCR) als auch ein CD4-Molekül, was ihnen ihren Namen verleiht. Der T-Zell-Rezeptor ist dafür verantwortlich, an ein Antigen zu binden, das von einem MHC-Klasse-II-Molekül präsentiert wird. Das CD4-Molekül bindet direkt an das MHC-Klasse-II-Molekül. Da das CD4-Molekül nicht an MHC-Klasse-I-Moleküle binden kann, stellt dies sicher, dass CD4-T-Zellen nur mit MHC-Klasse-II-Molekülen interagieren. Umgekehrt exprimieren CD8-T-Zellen einen T-Zell-Rezeptor und ein CD8-Molekül. Das CD8-Molekül kann nicht an MHC-Klasse-II-Moleküle binden, wodurch gewährleistet wird, dass CD8-T-Zellen ausschließlich mit MHC-Klasse-I-Molekülen interagieren.
5.5.4. Die Bedeutung der Lymphknoten für die adaptive Immunantwort
Eine adaptive Immunantwort entsteht, wenn naive T-Zellen in sekundären lymphatischen Organen wie den Lymphknoten auf aktivierte antigenpräsentierende Zellen (wie Dendritische Zellen) treffen. Diese spezialisierten Organe ermöglichen effektive Wechselwirkungen zwischen zirkulierenden Lymphozyten und ihren Zielantigenen.
Damit die seltenen antigenspezifischen T-Zellen effizient nach antigenpräsentierenden Zellen suchen können, zirkulieren sie ständig durch die lymphatischen Organe. Hier prüfen sie Antigene, die aus verschiedenen Geweberegionen herbeigebracht wurden.
Für die Auslösung einer adaptiven Immunantwort ist es entscheidend, dass Krankheitserreger oder ihre Antigene in die sekundären lymphatischen Organe transportiert werden. Ohne diesen Transport in die Lymphknoten können die T-Zellen nicht sensibilisiert werden, was zeigt, dass die adaptive Immunantwort nicht direkt im infizierten Gewebe initiiert wird, sondern in den lymphatischen Organen. Dort wird auch die Produktion von Antikörpern durch die aktivierten B-Zellen angeregt.
Die adaptive Immunantwort erfordert, dass Krankheitserreger oder ihre Antigene in die sekundären lymphatischen Organe wie Lymphknoten transportiert werden. Diese Organe sind essentiell für das Auslösen der Immunantwort, einschließlich der Produktion von Antikörpern.
[Die T-Zell-vermittelte Immunität]
5.5.5. Erkennungsphase
Die Aufgabe der dendritischen Zelle (DC) ist es, zwischen den Milliarden von T-Zell-Variationen die EINE passende T-Zelle zu finden, die mit dem gefundenen Erreger übereinstimmt. Die DC bleibt dafür im Lymphknoten und präsentiert ihr gefundenes Antigen, während die T-Zellen im Lymphknoten zirkulieren und die Antigen-MHC-II-Komplexe auf der Oberfläche der dendritischen Zelle abtasten. Man könnte sagen, dass die T-Zellen die dendritischen Zellen ‚beschnuppern‘ wie Gäste, denen man erstmal ‚Hallo‘ sagt. Dies kann verständlicherweise eine Weile dauern. Nur die T-Zellen, die an das Antigen binden können, werden selektiv aktiviert.
5.5.6. Aktivierungsphase
a) T-Zell-Aktivierung
b) B-Zell-Aktivierung
Sobald eine T-Zelle einen passenden Antigen-MHC-Komplex auf einer dendritischen Zelle erkennt, bindet sie daran. Dies kann mit einem festen und längeren Händedruck zur Begrüßung verglichen werden, der eine Reihe von Signalen in der T-Zelle auslöst und ihre Aktivierung bewirkt. Dieser erste Kontakt mit dem Antigen und die daraus resultierende Aktivierung naiver T-Zellen wird oft als Priming bezeichnet.
a) T-Zell-Aktivierung
Die Aktivierung naiver T-Zellen wird durch mehrere Signale kontrolliert (siehe untere Abbildung). Das primäre Signal ist die Erkennung des Antigen-MHC-Komplexes (1) auf der antigenpräsentierenden Zelle. Zusätzlich erfordert die T-Zell-Aktivierung auch die Erkennung von kostimulatorischen Signalen (zusätzliche Signale zur Aktivierung von Immunzellen, 2) und Zytokinen (3), die von der antigenpräsentierenden Zelle gesendet werden.
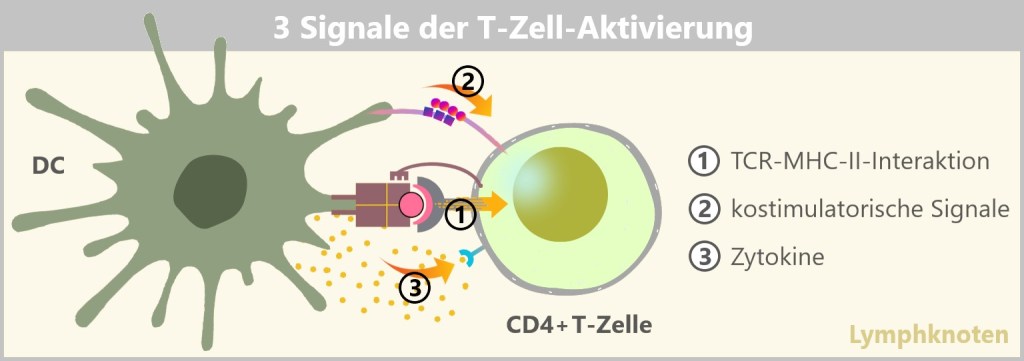
Diese verschiedenen Signale dienen als Verifizierungsschritte und fungieren als Schutzmechanismus, um eine Überreaktion des Immunsystems zu verhindern. Detaillierte Informationen zur T-Zell-Aktivierung findet man hier und hier.
Nach der Aktivierung verweilen die T-Zellen für mehrere Tage in der T-Zell-Zone des Lymphknotens. Während dieser Zeit beginnen sie sich zu teilen und zu differenzieren. Die naiven T-Zellen entwickeln sich zu T-Effektorzellen, die für unterschiedliche Aktivitäten spezialisiert sind. Die Differenzierung der T-Zellen in verschiedene T-Effektorzellen hängt von der Kombination der Zytokine und anderen Signalen ab, die während der Aktivierung und der anfänglichen Phase der Immunantwort präsent sind.
Einige aktivierte CD4-T-Zellen differenzieren sich zu T-Helferzellen (Th-Zellen), die andere Immunzellen unterstützen und die Immunantwort verstärken. Andere können zu regulatorischen T-Zellen (Treg) werden, die helfen, die Immunantwort zu kontrollieren und zu verhindern, dass das Immunsystem überreagiert und körpereigenes Gewebe angreift.
Aktivierte CD8-T-Zellen differenzieren sich in zytotoxische T-Zellen (Tc). Diese Tc-Zellen können infizierte Zellen oder Tumorzellen gezielt abtöten, indem sie zellschädigende Substanzen freisetzen.
Detaillierte Informationen zur T-Zell-Differenzierung findet man hier.
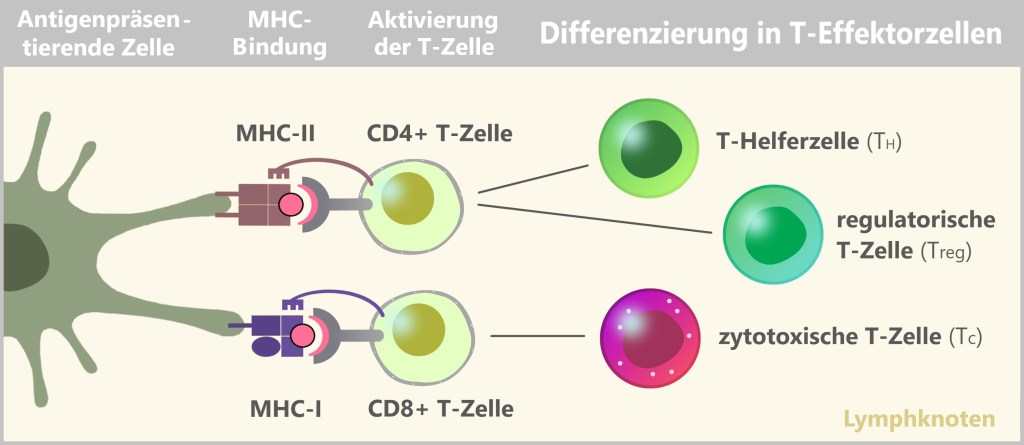
Die Aktivierung von CD4-T-Zellen findet in der Regel zuerst statt. Diese Zellen fungieren als Dirigenten der Immunreaktion. Sobald sie aktiviert sind, helfen sie dabei, die Arbeit anderer Immunzellen zu koordinieren, einschließlich der CD8-T-Zellen. Sie tun dies, indem sie bestimmte Botenstoffe (Zytokine) freisetzen und zusätzliche (kostimulatorische) Signale senden, die die Aktivierung und Unterstützung anderer Zellen des Immunsystems ermöglichen.
Insgesamt sorgen die Zytokine also dafür, dass die Immunantwort effektiver und gezielter abläuft, ähnlich wie ein Katalysator eine chemische Reaktion beschleunigt.
Bei der Teilung entstehen tausende von T-Zellen, die alle denselben spezifischen T-Zell-Rezeptor tragen, der das Antigen erkennt.

b) B-Zell-Aktivierung
B-Zellen können Antigene direkt aufnehmen, ohne auf dendritische Zellen angewiesen zu sein. Dennoch kann die Interaktion mit diesen Zellen wichtig für die Aktivierung der B-Zellen sein.
Über ihren B-Zell-Rezeptor (BCR), der in vielen verschiedenen Varianten existiert und dadurch eine breite Erkennung von Antigenen ermöglicht, binden B-Zellen spezifische Antigene direkt aus ihrer Umgebung.
Kleine Antigenmoleküle oder Partikel können direkt in die Lymphgefäße eindringen und mit der Lymphflüssigkeit zu den Lymphknoten transportiert werden, wo sie von B-Zellen aufgenommen werden. In diesem Fall befindet sich die B-Zelle bereits im Lymphknoten, wenn sie das Antigen aufnimmt und verarbeitet. Alternativ kann die B-Zelle auch außerhalb des Lymphknotens auf ein Antigen stoßen. In diesem Fall wandert sie nach der Antigenaufnahme zu den sekundären lymphatischen Organen wie den Lymphknoten.
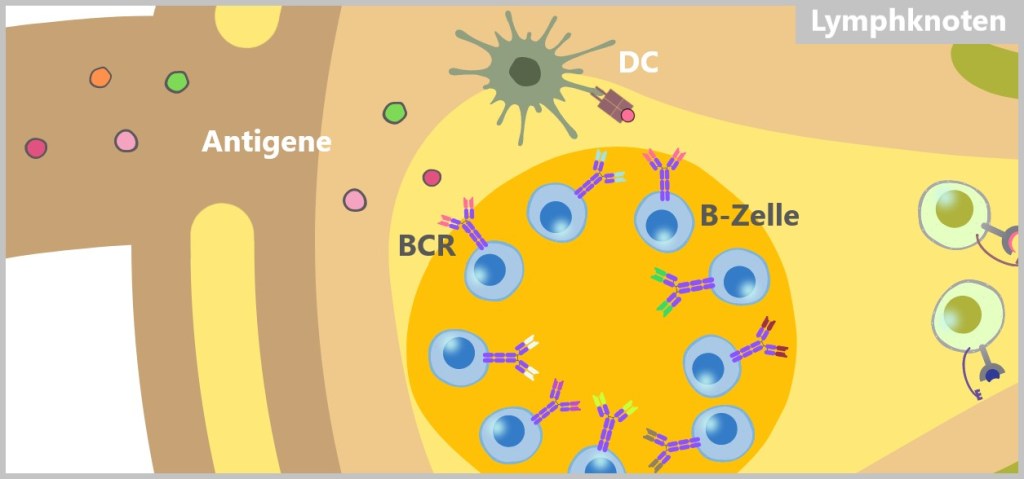
Nach der Bindung nehmen die B-Zellen das „freie“ Antigen samt BCR durch Endozytose auf, einem Prozess, bei dem sich die Zellmembran einstülpt und den BCR zusammen mit dem Antigen in die Zelle aufnimmt. Dort wird das Antigen intern verarbeitet und anschließend auf MHC-II-Molekülen präsentiert.

B-Zellen besitzen die Fähigkeit, sowohl direkt Antigene aus der Umgebung zu binden als auch von dendritischen Zellen präsentierte Antigene zu erkennen. Während die direkte Bindung an das Antigen der häufigste Weg ist, können B-Zellen in seltenen Fällen auch aktiviert werden, indem sie mit antigenpräsentierenden Zellen (wie dendritischen Zellen oder Makrophagen) interagieren. In diesem Fall erkennt eine B-Zelle das gleiche Antigen, das auf dem MHC-II-Molekül einer APC präsentiert wird. Diese Bindung zwischen dem BCR der B-Zelle und dem präsentierten Antigen führt zu einer Signalübertragung, die die B-Zelle aktiviert. Die APC kann zudem kostimulatorische Moleküle exprimieren, die zusätzliche Signale liefern, die die Aktivierung der B-Zelle verstärken. Dennoch reicht die Aktivierung einer B-Zelle durch eine APC in der Regel nicht aus, um die B-Zelle vollständig zu aktivieren. Die zusätzliche Unterstützung von T-Helferzellen ist in den meisten Fällen erforderlich.
Damit eine B-Zelle vollständig aktiviert wird, braucht sie in der Regel noch die Hilfe von T-Helferzellen. Dieser Prozess wird als T-Zell-abhängige B-Zell-Aktivierung bezeichnet.
T-Zell-abhängige B-Zell-Aktivierung
Bereits aktivierte T-Helferzellen wandern im Lymphknoten in die Grenzzone zwischen der T-Zell-Zone und der B-Zell-Zone, wo sie mit den B-Zellen interagieren.
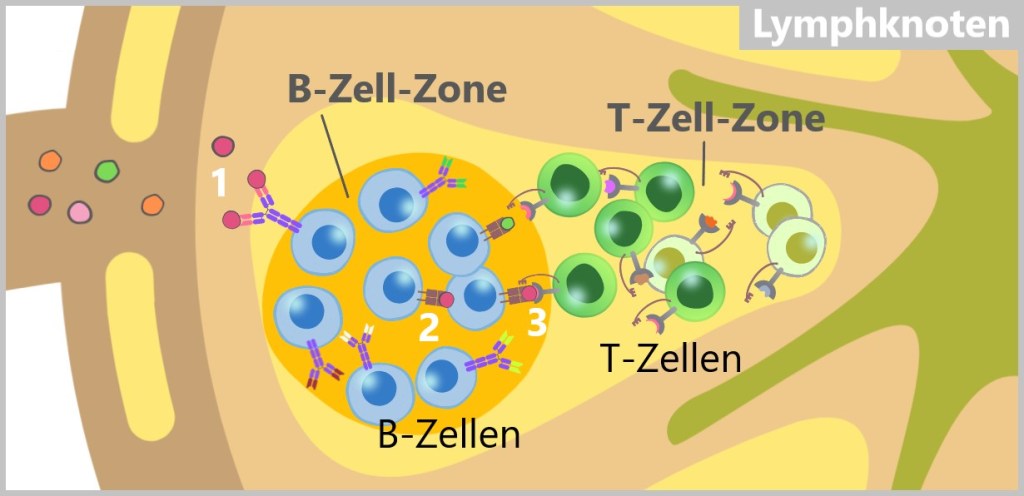
T-Helferzellen, die dasselbe Antigen erkannt haben, binden an den Antigen-MHC-II-Komplex auf der Oberfläche der B-Zellen. Diese Bindung liefert das erste Aktivierungssignal. Infolgedessen exprimieren T-Helferzellen kostimulatorische Moleküle (wie CD40L, die an den CD40-Rezeptor auf den B-Zellen binden). Dies liefert das zweite Signal für die vollständige Aktivierung der B-Zellen. Zusätzlich setzen T-Helferzellen auch Zytokine frei, die das Wachstum, die Differenzierung und die Funktion der B-Zellen fördern.
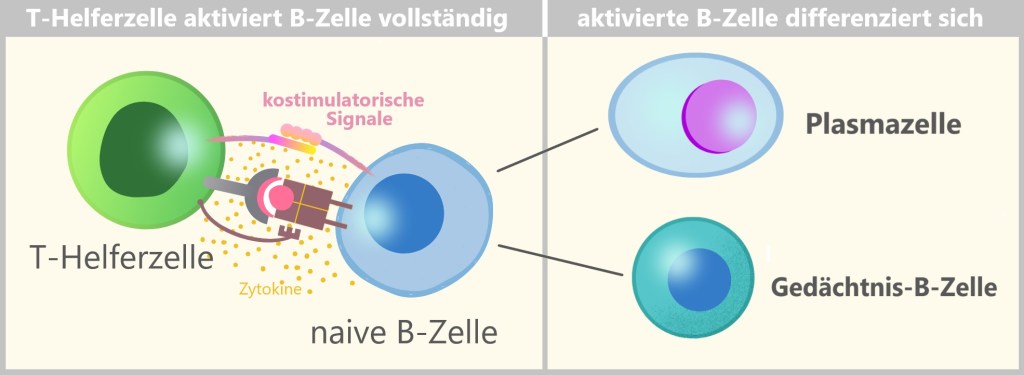
Dieser zweistufige Mechanismus – die Bindung an den Antigen-MHC-II-Komplex (erstes Signal) und die Interaktion mit kostimulatorischen Molekülen sowie die Freisetzung von Zytokinen (zweites Signal) – stellt eine wichtige Sicherheitskontrolle dar. Er sorgt dafür, dass eine Immunantwort nur dann ausgelöst wird, wenn sie wirklich notwendig ist. Eine alleinige Aktivierung der B-Zellen durch Antigenerkennung wäre weniger reguliert und könnte das Risiko unerwünschter Reaktionen erhöhen, wie etwa Autoimmunreaktionen.
Nach der vollständigen Aktivierung beginnen die B-Zellen zu proliferieren und sich in zwei Haupttypen zu differenzieren: in Plasmazellen und Gedächtnis-B-Zellen.
T-Zell-unabhängige B-Zell-Aktivierung
Die T-Zell-unabhängige B-Zell-Aktivierung ist ein weniger häufig vorkommender Mechanismus, der bevorzugt bei bestimmten bakteriellen Infektionen auftritt. Bei dieser Art der Aktivierung erkennen B-Zellen Antigene, die in der Regel repetitive Strukturen (d.h. sich wiederholende Muster) aufweisen, wie die Polysaccharide auf der Oberfläche von Bakterien. Diese Antigene können die B-Zell-Rezeptoren (BCRs) auf den B-Zellen direkt kreuzvernetzen und so eine Aktivierung auslösen, ohne die Hilfe von T-Helferzellen zu benötigen.
Während dieser Prozess schneller abläuft, führt er häufig zu einer weniger robusten und langlebigen Immunantwort im Vergleich zur T-Zell-abhängigen Aktivierung. Zudem entstehen hierbei meist keine Gedächtniszellen, was bedeutet, dass die Immunantwort bei einer erneuten Infektion mit demselben Pathogen nicht so stark und effizient ist.
5.5.7. Effektorphase
Während der Aktivierungsphase werden die Immunzellen auf den Erreger „vorbereitet“. In der Effektorphase treten diese aktivierten Immunzellen in Aktion, um den Erreger gezielt zu bekämpfen und zu beseitigen. In dieser Phase fungieren die Immunzellen als Effektoren, die spezifische Maßnahmen ergreifen, um die Infektion zu kontrollieren und zu eliminieren. Die meisten Effektor-T-Zellen verlassen den Lymphknoten, treten in die Blutbahn ein und wandern gezielt zur Infektionsstelle.
a) T-Helferzellen
b) Zytotoxische T-Zellen
c) Plasmazellen
a) T-Helferzellen
T-Helferzellen unterstützen an der Infektionsstelle andere Immunzellen wie Makrophagen, indem sie Zytokine ausschütten, die als Signalstoffe dienen. Diese Zytokine verstärken die Fähigkeit der Immunzellen, Mikroben durch Phagozytose zu beseitigen.
b) Zytotoxische T-Zellen
Zytotoxische T-Zellen hingegen spüren infizierte oder entartete Körperzellen auf und zerstören sie, indem sie den programmierten Zelltod (Apoptose) auslösen.
Zytotoxische T-Zellen (auch als CTLs oder CD8-T-Zellen bekannt) sind äußerst präzise in ihrer Wirkung. Sie erkennen spezifische Antigene, die in Verbindung mit MHC-I-Molekülen auf der Oberfläche infizierter oder abnormaler Zellen präsentiert werden.
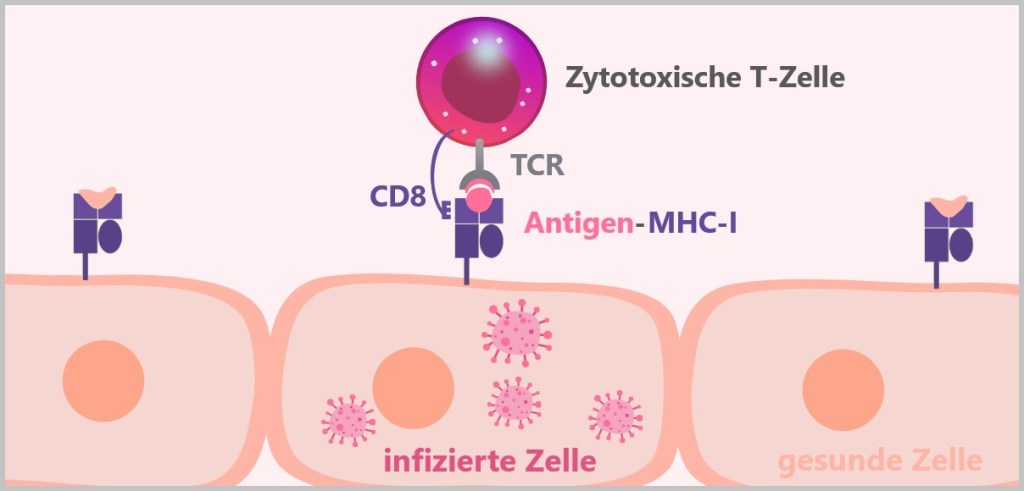
Nach dieser Erkennung zerstören sie gezielt nur die Zellen, die das entsprechende Antigen tragen. Die Eliminierung der Zielzellen erfolgt hauptsächlich auf zwei Wegen:
1) Tötung durch Perforine und Granzyme: Perforin bildet Poren in der Zellmembran der Zielzelle, was diese direkt schädigt und einen Kanal schafft, durch den Granzymen in die Zelle eindringen. Granzymen lösen in der Zielzelle den programmierten Zelltod (Apoptose) aus, was schließlich zur Zerstörung der Zelle führt.
2) Tötung durch Fas-Ligand (FasL): Zytotoxische T-Zellen exprimieren ein Molekül namens Fas-Ligand (FasL), das an den Fas-Rezeptor auf der Oberfläche der Zielzelle bindet. Diese Bindung aktiviert eine Signalkaskade, die ebenfalls die Apoptose einleitet.
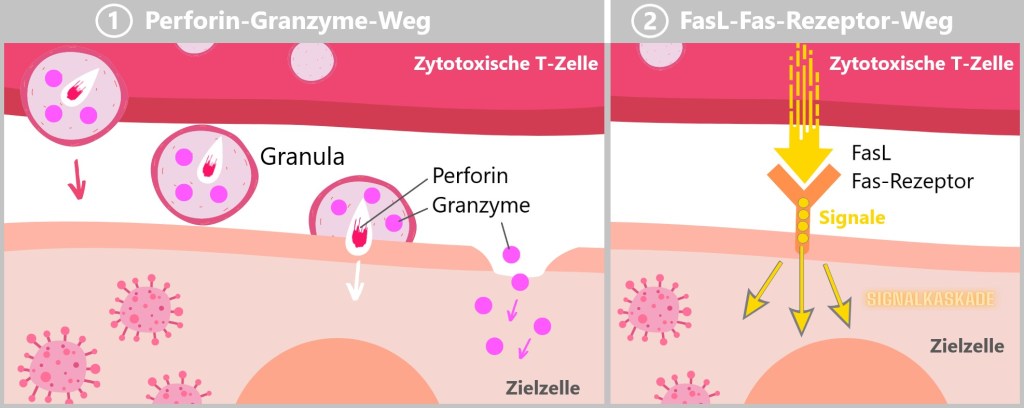
1) Nachdem die zytotoxische T-Zelle (CTL) an die Zielzelle gebunden hat, entleert sie spezielle Vesikel, sogenannte zytotoxische Granula, in den engen Kontaktbereich zwischen der CTL und der Zielzelle. Diese Granula enthalten Perforin und Granzymen. Perforin bildet Poren in der Zellmembran der Zielzelle, durch die Granzymen in das Zytoplasma eindringen. Dort lösen sie eine Reihe von Prozessen aus, die zur Zerstörung der Zell-DNA und zum Abbau von Zellproteinen führen, was einen geordneten Zelltod (Apoptose) ohne Entzündungsreaktionen bewirkt.
2) Trifft die CTL auf eine Zielzelle mit dem Fas-Rezeptor auf der Oberfläche, bindet ihr Fas-Ligand (FasL) direkt an diesen Rezeptor, ähnlich einem Schlüssel, der in ein Schloss passt. Diese Bindung aktiviert eine Signalkaskade in der Zielzelle, die zur Apoptose führt. Durch diese Signalkaskade beginnt die Zielzelle, sich selbst abzubauen und stirbt schließlich ab.
Zytotoxische T-Zellen agieren ähnlich wie Natürliche Killerzellen (NK-Zellen), jedoch mit einem entscheidenden Unterschied: Sie zerstören die Zielzellen kontrolliert und präzise, wodurch die umliegenden Gewebe weitgehend geschont werden.
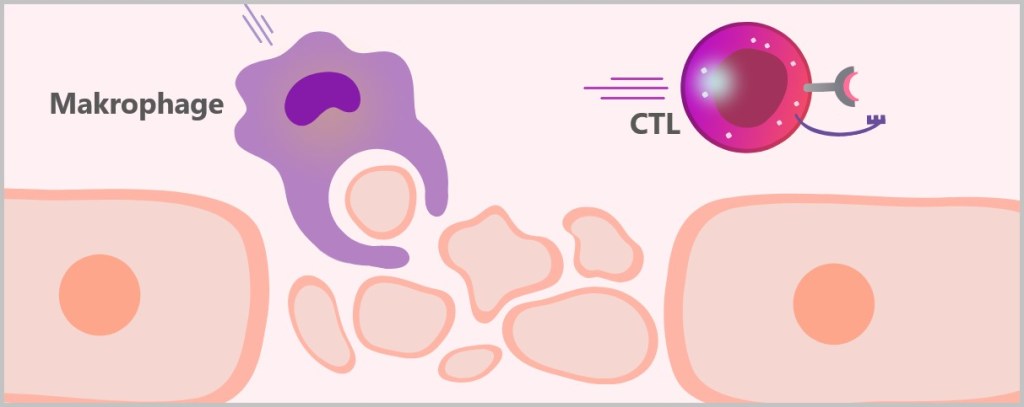
Diese Videos hier und hier veranschaulichen sehr gut, wie zytotoxische T-Killerzellen arbeiten.
c) Plasmazellen
Nachdem B-Zellen aktiviert wurden, beginnen sie sich rasch zu teilen und in Plasmazellen zu differenzieren, die darauf spezialisiert sind, große Mengen spezifischer Antikörper zu produzieren und freizusetzen. Um diesen komplexen Ablauf besser zu verstehen, schauen wir uns alles Schritt für Schritt an.
Die aktivierten B-Zellen teilen sich extrem schnell und oft, sodass aus wenigen initialen Zellen in kurzer Zeit tausende von identischen B-Zellen entstehen. Das ermöglicht dem Immunsystem, innerhalb weniger Tage eine große Anzahl an B-Zellen zu produzieren, die alle den passenden BCR tragen und sich entweder zu Plasmazellen differenzieren, um Antikörper zu produzieren, oder zu Gedächtniszellen werden.

Besonders faszinierend ist die Tatsache, dass der B-Zell-Rezeptor (BCR), der auf der Oberfläche jeder B-Zelle sitzt, bereits die Vorlage für den späteren Antikörper ist. Anders gesagt: Der BCR ist eine „Vorschau“ auf den Antikörper, den die Zelle nach ihrer Aktivierung massenhaft ausschütten wird.
Nochmal hervorzuheben dabei ist das wahre Meisterwerk der Natur: die Art und Weise, wie diese BCRs entstehen. Bereits während der Entwicklung der B-Zelle werden die Gensegmente, die den B-Zell-Rezeptor und somit den späteren Antikörper bilden, völlig zufällig miteinander kombiniert. Das Ergebnis der somatische Rekombination ist eine unfassbare Vielfalt an Antigenbindungsstellen – mit bis zu 10 Milliarden möglichen Varianten.

Die somatische Rekombination haben wir schon bei den T-Zell-Rezeptoren (TCR) kennengelernt. Wie bei den T-Zellen sorgt auch hier das zufällige Mischen von Genen dafür, dass eine große Vielfalt an Rezeptoren entsteht. Auf diese Weise stellt die Natur sicher, dass für nahezu jeden erdenklichen Eindringling bereits eine passende Immunzelle mit einem passenden Rezeptor zur Verfügung steht. Es ist, als würde das Immunsystem einen gigantischen Vorrat an „Schlüsseln“ (Antikörpern) bereithalten, von denen nahezu jeder zu einem neuen „Schloss“ (Antigen) passt, dem der Körper begegnet. Der entscheidende Unterschied ist jedoch, dass B-Zellen nicht nur Antigene erkennen, sondern auch die passenden Antikörper gegen sie freisetzen.
III – Dritte Verteidigungslinie: die Antikörper
Diese B-Zell-Rezeptoren (BCRs), die noch fest an der Zellmembran gebunden sind, werden auch als membrangebundene Antikörper oder Immunglobuline (Ig) bezeichnet. Sobald sich die B-Zelle in eine Plasmazelle verwandelt, wird der BCR in seiner löslichen Form freigesetzt – als voll funktionstüchtiger Antikörper.
Plasmazellen – die Antikörper-Fabriken Plasmazellen sind entscheidend für die Immunabwehr, da sie dem Immunsystem in großer Menge spezifische Antikörper bereitstellen. Jede Plasmazelle kann dabei bis zu 10.000 Antikörper pro Minute produzieren.
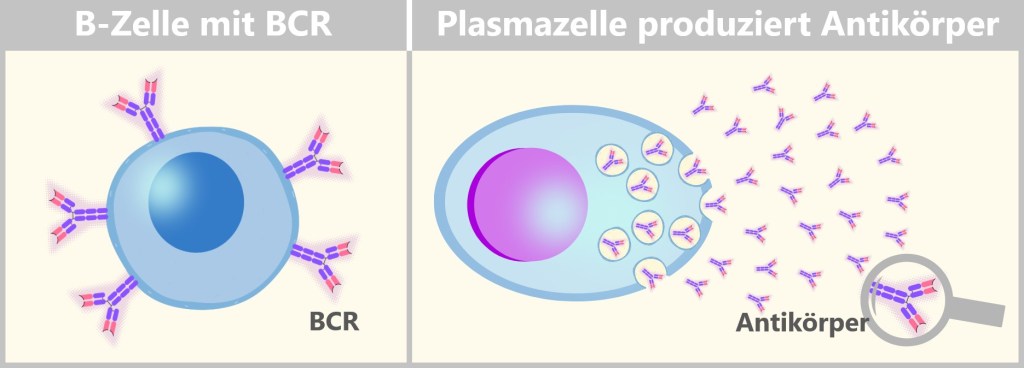
Detaillierte Darstellung der Antikörperproduktion
In diesem Abschnitt werden wir die Antikörperproduktion genauer betrachten. Dies ist eine gute Gelegenheit, unser Wissen aus den vorherigen Kapiteln zur Proteinherstellung auf die Antikörperproduktion anzuwenden.
Aktivierung der B-Zellen
Der Prozess beginnt, wenn eine B-Zelle durch ein spezifisches Antigen aktiviert wird. B-Zellen tragen auf ihrer Oberfläche B-Zell-Rezeptoren (BCRs), die Antigene binden (wie beispielsweise Teile eines Virus oder Bakteriums). Die Bindung löst ein Signal in der B-Zelle aus, das zur Aktivierung führt. Für eine vollständige Aktivierung sind jedoch in der Regel zusätzliche Signale (Zytokine) erforderlich, die von T-Helferzellen bereitgestellt werden.
Umwandlung in Plasmazellen
Nach der Aktivierung beginnen B-Zellen sich zu teilen (Proliferation). Ein Teil dieser Zellen differenziert sich zu Plasmazellen, die auf die Antikörperproduktion spezialisiert sind. Die Zelle verändert sich sowohl morphologisch als auch biochemisch, um ihre Funktion als „Antikörperfabrik“ zu erfüllen. Dabei vergrößert sich vor allem das raue endoplasmatische Retikulum (ER) stark, da es für die Synthese der Antikörper entscheidend ist.
Synthese der Antikörper
Der Bauplan für die Antikörper ist in der DNA der Plasmazelle gespeichert. Der Prozess der Antikörperproduktion erfolgt in mehreren Schritten:
Transkription und Translation
Die genetische Information für die Antikörper wird im Zellkern von der DNA in mRNA umgeschrieben (Transkription). Diese mRNA wird dann ins raue endoplasmatische Retikulum (ER) transportiert, wo die Synthese (Translation) der Antikörper erfolgt. In den Ribosomen des ER werden die Immunglobuline (Antikörper) zusammengesetzt. Im ER falten sich die Antikörper auch zu ihrer funktionalen, dreidimensionalen Struktur. Nur korrekt gefaltete Antikörper können spezifisch an Antigene binden.
Ein Antikörper besteht aus zwei schweren und zwei leichten Ketten, die zusammen eine Y-Form bilden. Diese Ketten werden durch spezifische Gene kodiert. Die Bindungsstellen (variable Regionen) der Antikörper sind aufgrund der somatischen Rekombination, die während der B-Zell-Entwicklung stattfindet, einzigartig und passen spezifisch zu dem Antigen, das die B-Zelle aktiviert hat. Diese Antikörper sind eine lösliche Version der BCRs.
Sekretion der Antikörper
Nach der Synthese werden die korrekt gefalteten Antikörper zum Golgi-Apparat transportiert, wo sie modifiziert und verpackt werden. In Vesikeln verpackt, wandern sie zur Zellmembran, wo die Vesikel mit der Membran verschmelzen und die Antikörper in den extrazellulären Raum abgegeben werden (Sekretion).
Plasmazellen sind extrem effizient und können Tausende von Antikörpern pro Sekunde produzieren und freisetzen. Diese Antikörper gelangen über das Blut oder die Lymphe zu den Infektionsstellen im Körper.
Plasmazellen können sich entweder im Lymphknoten ansiedeln, von wo aus sie Antikörper in die Lymphe und das Blut freisetzen, oder sie wandern ins Knochenmark, wo sie langfristig Antikörper produzieren, die ebenfalls von dort in die Blutgefäße gelangen. Manche Plasmazellen verbleiben auch in anderen Geweben, wie der Milz oder den Schleimhäuten.
5.5.8. Arten von Antikörpern
Jeder Antikörper setzt sich aus einer variablen und einer konstanten Region zusammen. Die variable Region, die durch somatische Rekombination entsteht, ist für die hochspezifische Erkennung von Antigenen verantwortlich.
Die konstante Region des Antikörpers bleibt unverändert und bestimmt die Klasse des Antikörpers. Man unterscheidet fünf Klassen (Isotype) von Immunglobulinen: M, G, A, D, E und bezeichnet sie mit den Kürzeln IgM, IgG, IgA, IgD, IgE.

Antikörper bestehen aus einer variablen und einer konstanten Region. Sie werden in zwei Fragmente unterteilt: den Fab-Bereich und den Fc-Bereich. Der Fab-Bereich umfasst die „Arme“ der Y-förmigen Struktur und ist für die Bindung an spezifische Antigene zuständig. Jeder Antikörper besitzt zwei Fab-Regionen, die jeweils eine variable Region enthalten, welche die Antigenbindungsstelle bildet. Der Fc-Bereich ist der „Stamm“ des Antikörpers und vermittelt Effektor-Funktionen des Immunsystems, indem er von Immunzellen wie Makrophagen und NK-Zellen sowie von Komplementproteinen erkannt und gebunden wird.
Während der Immunantwort werden zu unterschiedlichen Zeitpunkten verschiedene Antikörperklassen produziert:
Primäre Immunantwort
IgM: Dies ist der erste Antikörper, der während einer primären Immunantwort produziert wird. IgM-Antikörper erscheinen schnell nach der ersten Exposition (Begegnung) gegenüber einem Antigen und sind besonders wirksam bei der Aktivierung des Komplementsystems.
IgG: Obwohl IgM der erste Antikörper ist, wird auch IgG bereits bei der ersten Exposition produziert, jedoch etwas später. IgG hat eine höhere Affinität zum Antigen und zirkulieren über einen längeren Zeitraum im Blut, was einen länger anhaltenden Schutz bietet.
Sekundäre Immunantwort
IgG: Bei einer erneuten Exposition gegenüber demselben Antigen wird IgG viel schneller und in größerer Menge produziert als bei der primären Immunantwort. Es bietet dadurch einen effektiveren und schnelleren Schutz. IgG kann außerdem die Plazenta passieren und dem Fötus passiven Schutz bieten.
Spezifische Funktionen
IgA: Diese Antikörper kommen hauptsächlich in Schleimhäuten und Körperflüssigkeiten wie Speichel, Tränen und Muttermilch vor. Sie spielen eine zentrale Rolle beim Schutz der Schleimhäute vor Infektionen.
IgE: IgE ist hauptsächlich an allergischen Reaktionen beteiligt und spielt eine Rolle bei der Abwehr von Parasiten.
IgD: Die Funktion von IgD ist noch nicht vollständig geklärt, aber es wird vermutet, dass es bei der Aktivierung und Reifung von B-Zellen eine Rolle spielt.
Durch das Messen und Analysieren dieser Antikörperklassen kann man Rückschlüsse auf den Immunstatus, den Infektionszeitpunkt und die Art der Immunreaktion ziehen, was in der klinischen Diagnostik von großer Bedeutung ist.
a) IgM - der erste Antikörper
b) Klassenwechsel (Isotypenswitch) zu IgG
c) IgA - die Schutzbarriere der Schleimhäute
d) Schleimhautimmunität: Warum IgG dafür ungeeignet ist
a) IgM – der erste Antikörper
IgM ist der erste Antikörper, den Plasmazellen als Reaktion auf eine Erstinfektion produzieren. Das liegt daran, dass B-Zellen bereits die genetische Information zur Herstellung von IgM besitzen, die sie über ihren B-Zell-Rezeptor (BCR) nutzen.
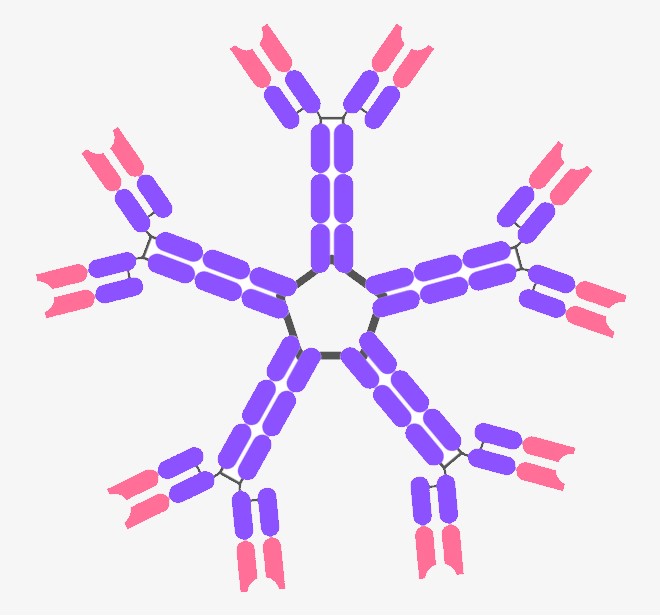
IgM-Antikörper kommen als Pentamer vor, was bedeutet, dass sie aus fünf einzelnen Antikörper-Einheiten bestehen, die zusammen ein großes, ringförmiges Molekül bilden.
Diese Struktur ermöglicht es IgM, bis zu zehn Bindungsstellen für Antigene zu haben (jeweils zwei pro Einheits-Antikörper), was eine besonders effektive Bindung an mehrere Antigenmoleküle gleichzeitig ermöglicht.
Hier sind einige Gründe für diese Struktur von IgM:
Erhöhte Bindungsfähigkeit: Durch ihre pentamere Struktur können IgM-Antikörper mehrere Antigene gleichzeitig binden. Dies erhöht ihre Fähigkeit, große Antigenmengen zu erfassen und zu neutralisieren.
Effektive Komplementaktivierung: Die große Anzahl von Bindungsstellen auf IgM ermöglicht eine besonders effiziente Aktivierung des Komplementsystems. IgM kann durch die Bindung an Antigene und die darauffolgende Bindung an Komplementproteine eine starke immunologische Reaktion auslösen.
Allerdings neigen IgM-Antikörper dazu, nicht sehr stark am Krankheitserreger zu haften und abzufallen. Daher bieten sie anfänglich noch nicht den optimalen Schutz. IgM kann jedoch schnell und in großen Mengen produziert werden, es ist sozusagen der „erste Wurf“ der Antikörperproduktion. IgM-Antikörper kommen vor allem im Blut vor.
b) Klassenwechsel (Isotypenswitch) zu IgG
Nachdem das Immunsystem bei einer Infektion anfänglich IgM-Antikörper produziert hat, stellt es später auf die Produktion von IgG-Antikörper um. Diese Umstellung wird als Klassenwechsel oder Isotypenswitch bezeichnet. Der Grund dafür ist, dass IgG-Antikörper für eine gezieltere und länger anhaltende Abwehr besser geeignet sind.
Während einer Infektion werden fortlaufend B-Zellen aktiviert, die zuvor durch Proliferation entstanden sind. Der Wechsel von IgM zu IgG wird durch Signale von T-Helferzellen angestoßen. Diese senden Zytokine (spezielle Botenstoffe) an die B-Zellen. Diese Signale geben den B-Zellen das „Okay“, die Produktion von IgG-Antikörpern aufzunehmen, die effizienter im Kampf gegen den Erreger sind.
IgG-Antikörper sind in vielerlei Hinsicht besser als IgM:
Größere Affinität: Im Verlauf der Immunantwort durchlaufen die B-Zellen einen Prozess, der als Affinitätsreifung bezeichnet wird. Dabei werden die Antikörper immer besser darin, das Antigen fest zu binden. Diese verbesserten IgG-Antikörper binden nicht nur stärker und spezifischer an das Antigen, sondern neutralisieren den Erreger auch effektiver.
Die Affinitätsreifung ist eine DNA-„Verbesserung“ im Laufe der Infektion. Während der Immunantwort werden die B-Zellen von den T-Helferzellen auch dazu angeregt, ihre Antigenbindungsstellen (variable Regionen der BCR) zu verbessern. Dies geschieht durch einen Prozess, der als somatische Hypermutation bekannt ist. Dabei treten gezielte Mutationen in der DNA der B-Zellen auf, die die Bindungsstellen ihrer Antikörper weiter optimieren. B-Zellen mit besonders gut passenden Antikörpern (hohe Affinität) werden bevorzugt.
Kleiner und flexibler: IgG-Moleküle sind kleiner und beweglicher als IgM. Dadurch können sie leichter durch das Gewebe dringen und auch in schwer zugängliche Bereiche gelangen, wo die Infektion möglicherweise stattfindet.
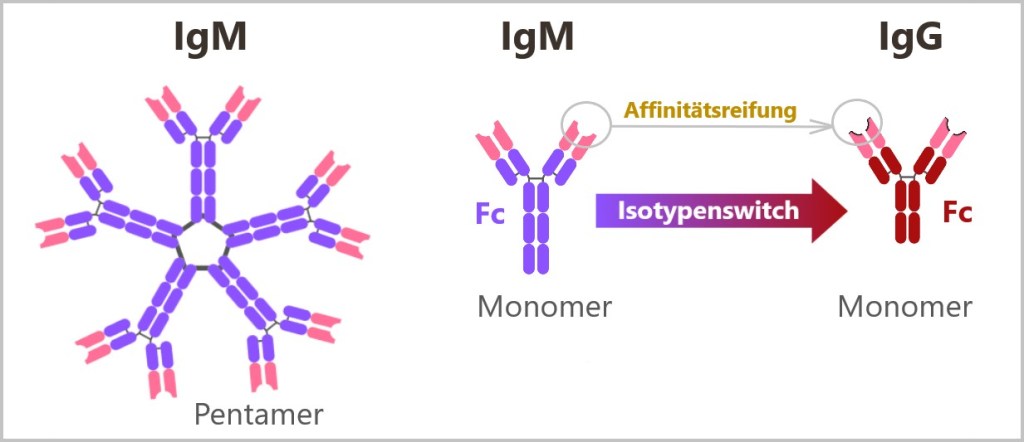
Längere Halbwertszeit: IgG bleibt länger im Blutkreislauf und bietet so einen längerfristigen Schutz vor dem Erreger.
Plazenta-Passage: IgG kann die Plazenta passieren und dem Fötus während der Schwangerschaft passiven Schutz bieten, wodurch das Neugeborene in den ersten Lebensmonaten besser vor Infektionen geschützt ist.
Immunologisches Gedächtnis: IgG-Antikörper spielen eine Schlüsselrolle im immunologischen Gedächtnis. Nach einer Infektion werden spezielle Gedächtniszellen gebildet, die bei einer erneuten Exposition gegenüber demselben Erreger schnell große Mengen an IgG-Antikörpern produzieren können. Dadurch reagiert das Immunsystem bei einer Zweitinfektion viel schneller und effektiver.
Grafische Zusammenfassung
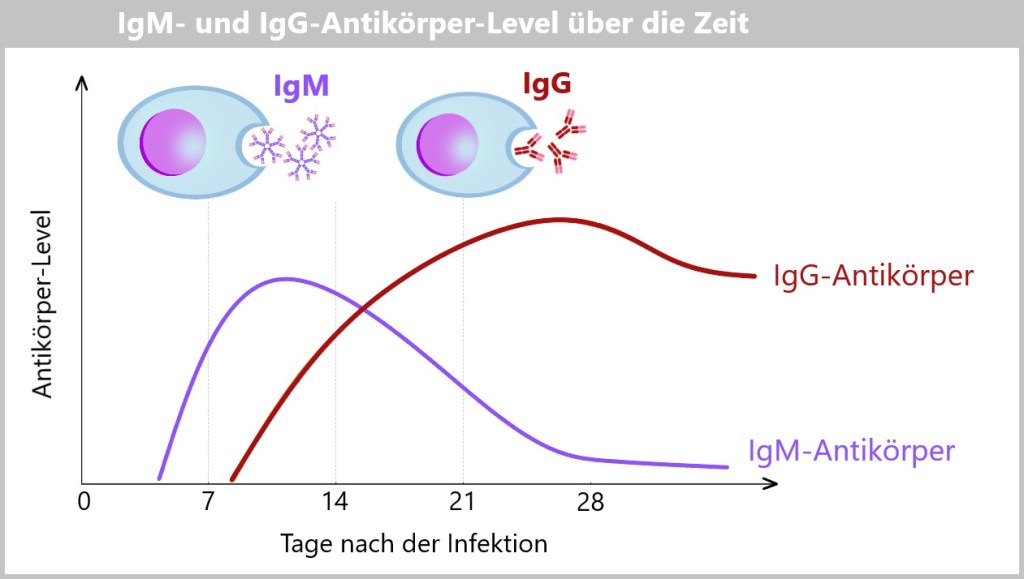
IgM-Antikörper werden in den frühen Stadien einer Infektion gebildet und sind bereits vier bis sieben Tage nach der Infektion nachweisbar. IgG-Antikörper hingegen entstehen etwa sieben bis vierzehn Tage nach der Infektion und können, abhängig vom Antigen und der individuellen Immunantwort, über Monate oder sogar Jahre hinweg nachgewiesen werden. Während IgM-Antikörper kurzlebig sind und oft auf eine akute Infektion hinweisen, sind IgG-Antikörper langlebiger und spielen eine zentrale Rolle bei der Entwicklung einer dauerhaften Immunität.
Detaillierte Informationen zu diesen Prozessen findest du in den folgenden Quellen:
„Antibodies & the B cell Receptor”,
„B cells & Plasma Cells“ und
„Antikörper – Abwehrmechanismen der B-Zellen“.
IgG-Antikörper sind die am häufigsten vorkommende Antikörperklasse im Blut und in anderen Körperflüssigkeiten. Sie finden sich in großer Zahl im Blutkreislauf sowie in Geweben und Organen und sind entscheidend für die Immunantwort gegen Infektionen, die bereits in den inneren Bereichen des Körpers lokalisiert sind. Im Gegensatz dazu übernehmen IgA-Antikörper eine spezialisierte Funktion, indem sie als Schutzbarriere der Schleimhäute fungieren. Entsprechend unterscheidet man zwischen dem systemischen Immunsystem, das den gesamten Körper schützt, und dem mukosalen Immunsystem, das speziell die Schleimhäute verteidigt.
c) IgA – die Schutzbarriere der Schleimhäute
Während IgG sich auf die Bekämpfung von Krankheitserregern im Inneren des Körpers konzentriert, schützen IgA-Antikörper die äußeren Schleimhäute, die den Übergang von außen nach innen markieren. Sie sind die Hauptakteure der Schleimhaut-Immunität und dafür zuständig, den Körper an Schleimhautoberflächen (wie im Verdauungstrakt, den Atemwegen oder dem Urogenitaltrakt) vor eindringenden Pathogenen zu schützen. IgA Antikörper befinden sich auch in Körperflüssigkeiten wie Speichel und Tränen.
Schleimhäute bilden eine kritische Barriere zwischen unserem Inneren und der äußeren Umgebung. In diesem Kontext ist es interessant zu betrachten, dass aus biologischer Sicht alles, was sich in unserem Verdauungstrakt befindet, als außerhalb unseres Körpers betrachtet wird. Vom Mund bis zum After verläuft ein kontinuierlich mit Schleimhaut ausgekleideter Hohlraum – eine „Verdauungshöhle“, in die wir Nahrung aufnehmen und in der Verdauungsenzyme sowie Verdauungssäfte abgegeben werden. Obwohl diese Höhle innerhalb des Körpers liegt, wird ihr Inhalt biologisch als Außengebiet angesehen.
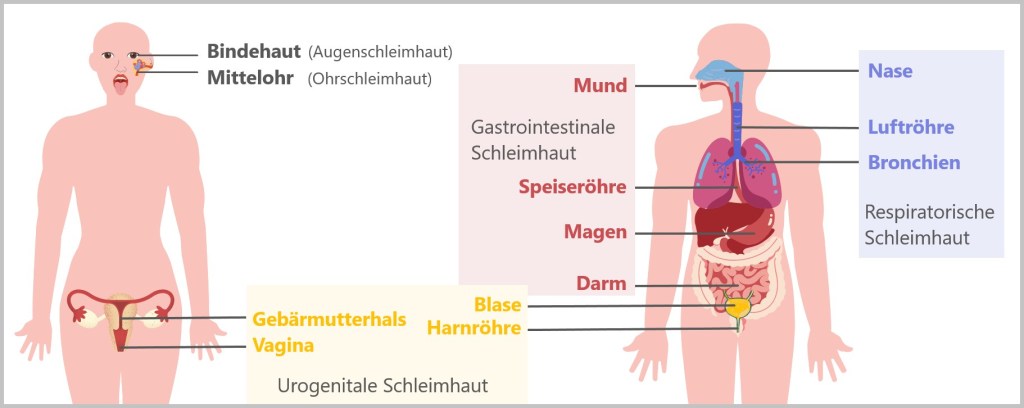
Da Schleimhäute im ständigen Kontakt mit der Außenwelt stehen, ist der Schutz durch IgA besonders wichtig.
Die Immunantwort auf Erreger, die über die Schleimhäute in den Körper gelangen, verläuft ähnlich wie bei Erregern, die direkt in den Körper eindringen. Der folgende Ablauf beschreibt die Reaktion des Immunsystems auf einen Virus, der über die Schleimhaut in den Körper gelangt. Durch die bisherigen Erläuterungen kannst du dir den Ablauf schon sehr gut vorstellen.
Erster Kontakt mit dem Virus – Angeborene Immunabwehr:
Wenn ein Virus über die Schleimhaut im Mund in den Körper eindringt, reagieren dort sofort Immunzellen wie Makrophagen, dendritische Zellen und andere Abwehrzellen. Diese lösen Alarm aus und rufen weitere Immunzellen zum Infektionsort. Dendritische Zellen und Makrophagen erkennen den Virus über ihre Mustererkennungsrezeptoren (PRRs) und nehmen ihn durch Phagozytose auf. Anschließend verarbeiten sie den Virus und präsentieren Virusfragmente (Antigene) auf MHC-II-Komplexen auf ihrer Oberfläche. Danach wandern sie über die Lymphgefäße zum nächstgelegenen Lymphknoten, zum Beispiel im Halsbereich, wo sie die Antigene den T-Helferzellen präsentieren.
Aktivierung der T-Helferzellen – Adaptive Immunabwehr:
Im Lymphknoten erkennen naive T-Zellen das präsentierte Virus-Antigen auf den MHC-II-Molekülen der dendritischen Zellen. Diese Interaktion aktiviert die T-Zellen, sie differenzieren sich, unter anderem zu T-Helferzellen, die die Immunantwort gezielt verstärken.
Aktivierung der B-Zellen – Adaptive Immunabwehr:
Aktivierte T-Helferzellen interagieren mit B-Zellen, die das Virus-Antigen aufgenommen und über MHC-II-Moleküle präsentiert haben. T-Helferzellen binden mit ihrem T-Zell-Rezeptor (TCR) an den MHC-II-Komplex der B-Zellen und senden über kostimulatorische Moleküle (wie CD40L) das Aktivierungssignal an die B-Zellen. Dieses Signal führt dazu, dass die B-Zellen sich zu Plasmazellen differenzieren, die große Mengen an Antikörpern produzieren. Zu Beginn der Immunantwort stellen sie hauptsächlich IgM her, da dies die erste Antikörperklasse ist, die vom Immunsystem gebildet wird.
Klassenwechsel (Isotyp-Switch) zu IgA:
Im weiteren Verlauf der Immunantwort, wenn der Körper die Infektion bekämpft, geben aktivierte T-Helferzellen spezielle Signale (Zytokine) ab. Diese Signale unterstützen die B-Zellen dabei, die Art der produzierten Antikörper anzupassen. Ein wichtiges Signal, TGF-β, führt dazu, dass die B-Zellen den Klassenwechsel durchführen und beginnen, IgA-Antikörper zu produzieren. Dieser Wechsel ist vor allem in der Nähe von Schleimhäuten entscheidend, da IgA eine wichtige Rolle bei der Schleimhautimmunität spielt. Nach dem Klassenwechsel differenzieren sich die B-Zellen weiterhin zu Plasmazellen, die dann IgA statt IgM produzieren.
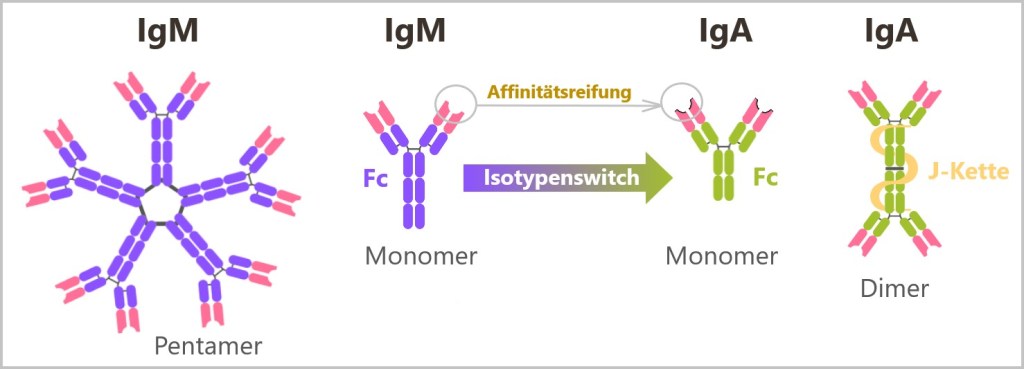
In der ersten Phase produziert die Plasmazelle IgM-Antikörper. Durch den Isotypenswitch stellt die B-Zelle später auf die Produktion von IgA-Antikörper um. Auch IgA-Antikörper durchlaufen eine Affinitätsreifung, um ihre Bindungsstärke zu Antigenen zu optimieren, bevor sie in die Schleimhäute transportiert werden. Plasmazellen können sowohl IgA-Monomere als auch IgA-Dimere produzieren, abhängig davon, wo sie sich befinden und welche spezifische Immunantwort benötigt wird. IgA-Monomere werden hauptsächlich in systemischen Bereichen produziert, also im Blut und in Geweben, die nicht mit Schleimhäuten verbunden sind. Mucosale Plasmazellen in den Schleimhäuten werden durch Signale aus ihrer Umgebung darauf „programmiert“, dimeres IgA zu produzieren. Diese Umgebung fördert die Produktion der J-Kette, die zur Dimerisierung von IgA führt.
Sekretion von IgA an Schleimhäuten:
Die aktivierten Plasmazellen, die sich in den Schleimhäuten ansiedeln, produzieren und sekretieren sekretorisches IgA (sIgA). sIgA wird über ein spezielles Transportsystem in das Lumen der Schleimhäute (den Raum, der von der Schleimhaut umgeben ist), zum Beispiel in den Mundraum, abgegeben. Dort kann es das Virus neutralisieren, indem es sich an das Virus bindet und dessen Eindringen in die Schleimhautzellen verhindert.
Durch diese neutralisierende Wirkung des IgA wird der Virus unschädlich gemacht, bevor er tiefer in den Körper eindringen und weiteren Schaden anrichten kann.
Neben der Produktion von sekretorischem IgA (sIgA) an den Schleimhäuten wird auch IgG produziert. IgG sorgt für einen systemischen Immunschutz und ist bedeutend, wenn Pathogene wie Viren die Schleimhautbarriere überwinden und in das Gewebe oder den Blutkreislauf eindringen. Beide Antikörper, IgA und IgG, arbeiten also komplementär, um eine umfassende Abwehr zu gewährleisten.
Struktur des IgA
In den Schleimhäuten, wie im Verdauungstrakt, den Atemwegen und dem Urogenitaltrakt, liegt IgA überwiegend in dimerer Form vor. Diese Struktur ist speziell an die Umgebung der Schleimhäute angepasst, die durch ständigen Kontakt mit Mikroorganismen, Enzymen und potenziell schädlichen Substanzen gekennzeichnet ist. In dieser rauen Umgebung benötigen Antikörper zusätzlichen Schutz und Stabilität. Das dimere IgA wird von Plasmazellen in mucosalen Lymphgeweben produziert. Von dort wird das IgA durch die Epithelzellen der Schleimhäute in die äußeren Bereiche der Schleimhäute transportiert. Während dieses Transports wird es mit einem sekretorischen Stück (pIgR) ausgestattet (siehe untere Abbildung), das ihm zusätzliche Stabilität verleiht und es vor enzymatischem Abbau schützt. Dadurch bleibt das dimere IgA in der Schleimhautumgebung funktionsfähig und kann seine Schutzfunktion erfüllen.

1) Das dimerisierte IgA, das von den Plasmazellen in der Lamina propria (unter der Schleimhaut) produziert wurde, bindet an den Poly-Ig-Rezeptor (pIgR), der sich auf der basolateralen Oberfläche der Epithelzellen (unterhalb der Epithelzelle) befindet. Der Poly-Ig-Rezeptor ist speziell dafür geeignet, an polymerisierte Immunglobuline (wie dimeres IgA oder pentameres IgM) zu binden, die eine J-Kette besitzen. 2) Der Poly-Ig-Rezeptor mit dem daran gebundenen IgA-Dimer wird dann durch die Epithelzelle transportiert (Transzytose), also von der basolateralen Seite (unterhalb der Epithelzelle) zur apikalen Seite (der Seite, die zur Schleimhaut zeigt). 3) Sobald das IgA-Dimer die apikale Oberfläche der Epithelzelle erreicht, wird ein Teil des Poly-Ig-Rezeptors abgespalten und bleibt als sekretorische Komponente (das sekretorische Stück) fest mit dem IgA-Dimer verbunden. Durch diese Bindung wird das dimerisierte IgA zu sekretorischem IgA (sIgA). Diese Abspaltung geschieht vor der Freisetzung in die Schleimschicht. 4) Das jetzt vollständig gebildete sIgA wird schließlich in die Schleimschicht abgegeben, wo es seine Schutzfunktion ausübt, indem es Mikroorganismen bindet und neutralisiert.
Das dimere IgA bietet auf der Oberfläche der Schleimhäute einen besonders effizienten Schutz, da es durch die Dimerstruktur eine bessere Bindung an Pathogene und die Schleimhautschicht ermöglicht. Es kann mehrere Antigen-Bindungsstellen bereitstellen, was die Neutralisation von Krankheitserregern erleichtert und deren Anhaftung an die Epithelzellen verhindert.
In geringen Mengen kommt IgA auch im Blutkreislauf vor, allerdings überwiegend in monomerer Form. Als Monomer ist IgA kleiner und kann daher leichter durch den Blutstrom zirkulieren. Dies ermöglicht eine schnelle Reaktion auf Pathogene oder Antigene, bevor diese sich im Körper verbreiten. Im Blut erfüllt das monomere IgA somit eine Funktion als „frühe Abwehr“, indem es direkt an Krankheitserreger binden kann.
d) Schleimhautimmunität: Warum IgG dafür ungeeignet ist
In der Schleimschicht, die die Schleimhäute auskleidet, sind vor allem die Antikörper IgA und in geringerem Maße IgM entscheidend für die Immunabwehr, während IgG in der Regel hier nicht vorkommt. Der Grund liegt in der besonderen Struktur und Funktion der Immunglobuline sowie im Mechanismus des Transports durch die Epithelzellen.
IgA, insbesondere in seiner dimeren Form, ist speziell für den Schutz der Schleimhäute angepasst.
Es wird von den Plasmazellen in der Lamina propria unter der Schleimhaut produziert und über den Poly-Ig-Rezeptor (pIgR) auf den Epithelzellen an die Schleimhautoberfläche transportiert. Dabei bindet der pIgR spezifisch an die J-Kette des dimeren IgA, was ermöglicht, dass dieses Antikörpermolekül sicher durch die Epithelzelle geschleust wird. Bei diesem Transportprozess wird ein Teil des pIgR als sekretorische Komponente an das IgA gebunden, wodurch es zu sekretorischem IgA (sIgA) wird. Diese sekretorische Komponente schützt das IgA vor enzymatischem Abbau in der aggressiven Umgebung der Schleimhäute und ermöglicht so eine stabile Immunabwehr.
Im Gegensatz dazu kommt IgG, das nur als Monomer existiert, in den Schleimhäuten nicht vor.
IgG hat keine J-Kette und kann daher nicht an den Poly-Ig-Rezeptor binden. Es fehlt IgG somit die Fähigkeit, über diesen Mechanismus in die Schleimschicht transportiert zu werden. IgG zirkuliert hauptsächlich im Blut und Gewebe, wo es systemische Abwehrfunktionen übernimmt, während die mucosale Immunabwehr auf sIgA angewiesen ist. Auch IgM, das als Pentamer mit einer J-Kette vorliegt, kann in geringen Mengen durch den pIgR in die Schleimschicht transportiert werden. Aufgrund seiner Struktur ist es ebenfalls gut für den Schutz in den Schleimhäuten geeignet. Dennoch bleibt sIgA der wichtigste Antikörper in der Schleimschicht, der gezielt Pathogene wie Viren neutralisiert und deren Eindringen in den Körper verhindert.
5.5.9. Die Wirkungsphase der Antikörper
Nachdem die IgG-Antikörper ins Blut gelangt sind, können sie nahezu jeden Bereich des Körpers erreichen, einschließlich der Lymphknoten und der Orte, an denen Infektionen auftreten. IgA-Antikörper hingegen entfalten ihre schützende Wirkung hauptsächlich an den Schleimhäuten, wo sie lokal produziert und direkt in die Schleimschicht abgegeben werden.
Die Antikörper wirken auf verschiedene Weisen, um den Körper vor Infektionen zu schützen:
Erkennung und Bindung: Antikörper erkennen spezielle Strukturen auf der Oberfläche von Krankheitserregern, die sogenannten Antigene, und binden sich daran. Dabei entstehen Antigen-Antikörper-Komplexe (Immunkomplexe IC). Dies ist der erste Schritt, um den Erreger unschädlich zu machen.
Neutralisation: Durch die Bindung an die Antigene blockieren die Antikörper die gefährlichen Teile von Toxinen und Krankheitserregern, sodass diese den Körper nicht weiter schädigen können.
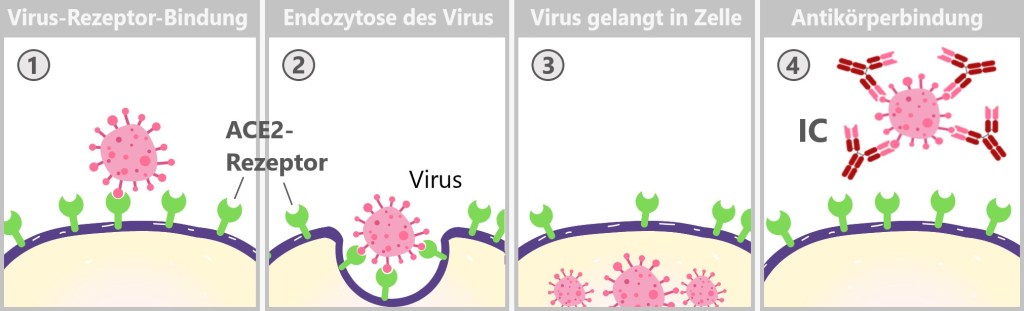
1) Das Virus bindet spezifisch an den ACE2-Rezeptor, ein Protein, das auf der Oberfläche vieler Zellen, besonders in der Lunge, vorkommt. Diese Bindung ist der erste Schritt der Infektion, der dem Virus den Zugang zur Zelle ermöglicht. 2) Nach der Bindung an den ACE2-Rezeptor wird das Virus durch rezeptorvermittelte Endozytose in die Zelle aufgenommen. Dieser Prozess führt zur Bildung eines Endosoms, das das Viruspartikel in die Zelle hinein transportiert. 3) Das Virus hat die Zellmembran durch Endozytose erfolgreich durchdrungen und befindet sich nun im Inneren der Zelle. Hier beginnt das Virus, die zellulären Mechanismen zu nutzen, um sich zu replizieren und die Zelle zu infizieren. 4) Antikörper erkennen und binden spezifisch an das Virus, was dessen Neutralisation bewirkt. Diese Bindung verhindert, dass das Virus an weitere Zellen andockt und diese infiziert, und markiert das Virus für die Zerstörung durch das Immunsystem.

1) Bakterien heften sich mithilfe von Adhäsinen an die Zelloberfläche und beginnen die Besiedelung. 2) Einige Bakterien werden von den Zellen aufgenommen und vermehren sich in speziellen Vesikeln im Zellinneren. 3) Antikörper binden an die Adhäsine der Bakterien und verhindern so deren Anhaftung und Aufnahme in die Zellen.
Markierung für Immunzellen: Antikörper können Krankheitserreger markieren, sodass bestimmte Immunzellen, wie Fresszellen, sie leichter erkennen und zerstören können. Dieser Prozess wird Opsonierung genannt.
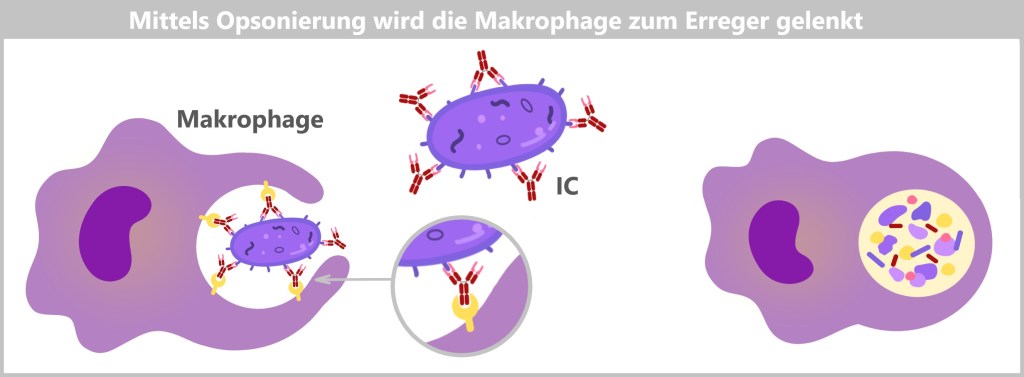
Die Makrophage erkennt den Immunkomplex (IC) durch spezialisierte Rezeptoren auf ihrer Oberfläche, die an die konstante Region der angehängten Antikörper binden. Sobald der Immunkomplex erkannt ist, verschlingt die Makrophage den gesamten Erreger und bildet ein Phagosom. Dieses Phagosom verschmilzt dann mit Lysosomen, die spezielle Verdauungsenzyme enthalten. In dem so entstandenen Phagolysosom werden sowohl der Erreger als auch die gebundenen Antikörper durch diese Enzyme abgebaut. Die abgebauten Proteine werden in kleinere Bestandteile zerlegt, die dann entweder von der Zelle wiederverwendet oder als Abfall ausgeschieden werden.
Aktivierung des Komplementsystems: Die Bindung der Antikörper kann auch eine Kaskade von Reaktionen auslösen, die als Komplementsystem bekannt ist (wie in Kapitel 5.4. ‚Das Komplementsystem‘ beschrieben). Diese Kette von Reaktionen führt zur Zerstörung der markierten Krankheitserreger.

1) Das Komplementprotein C1 bindet an die Antikörper auf der Bakterienoberfläche und startet die Abwehrreaktion. (Im klassischen Weg der Komplementaktivierung durch Antikörper müssen in der Regel mindestens zwei Antikörpermoleküle an das Antigen binden. Diese Bindung bringt die konstanten Regionen der Antikörper näher zusammen, was für die effiziente Bindung des ersten Komplementproteins (C1) notwendig ist.) 2) Komplementproteine formen den Membranangriffskomplex (MAK), der Löcher in die Zellmembran des Bakteriums bohrt. 3) Durch die entstandenen Poren verliert das Bakterium seine Stabilität und löst sich auf (Lyse).
Zellzerstörung durch das Immunsystem: In einigen Fällen binden Antikörper an infizierte Zellen oder Krebszellen und markieren sie für spezielle Immunzellen, wie z. B. natürliche Killerzellen (NK-Zellen). Diese Immunzellen erkennen die markierten Zellen und zerstören sie gezielt. Dieser Vorgang wird als ADCC (antikörperabhängige zelluläre Zytotoxizität) bezeichnet.
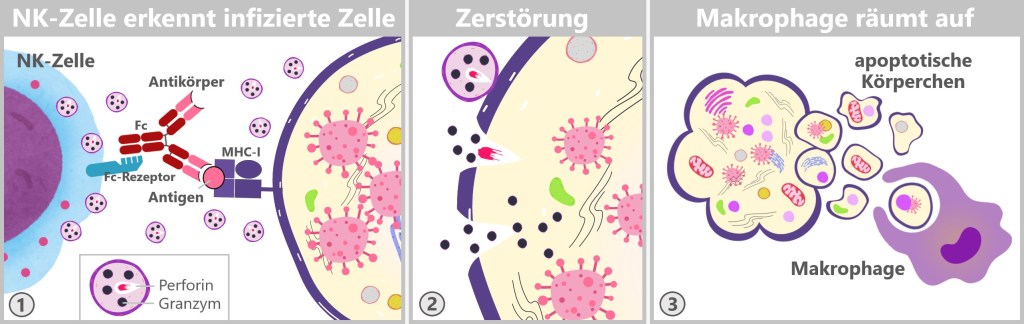
1) Eine NK-Zelle bindet an einen Antikörper, der an den Antigen-MHC-I-Komplex einer infizierten Zelle geheftet ist, und setzt zytotoxische Granula frei. 2) Die freigesetzten Substanzen dringen in die Zelle ein, durchlöchern die Membran und lösen den programmierten Zelltod (Apoptose) aus. 3) Nach dem Zelltod bleiben apoptotische Körperchen zurück, die von einer Makrophage aufgenommen und verdaut werden.
Verklumpung von Erregern (Agglutination): Die Agglutination ist ein Prozess, bei dem Antikörper mehrere Krankheitserreger (wie Bakterien, Viren oder fremde Zellen) gleichzeitig binden und sie dadurch miteinander verklumpen lassen. Diese Verklumpung erschwert es den Erregern, sich zu bewegen, zu vermehren oder Zellen zu infizieren. Außerdem wird es für das Immunsystem einfacher, diese größeren Klumpen zu erkennen und zu beseitigen. Makrophagen und andere Fresszellen können die verklumpten Erreger effizienter aufnehmen und verdauen, da sie durch die Agglutination konzentriert und leichter erreichbar sind.
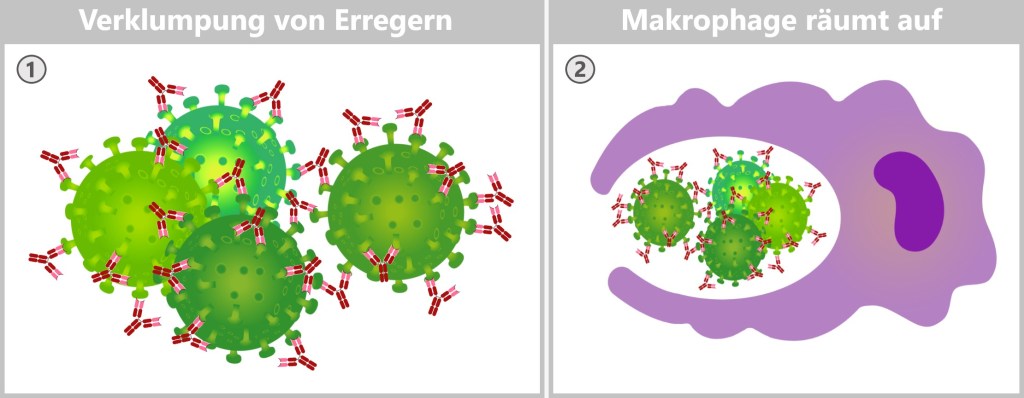
1) Antikörper binden mehrere Erreger und verklumpen sie, wodurch das Immunsystem sie leichter beseitigen kann. 2) Makrophagen haben eine außergewöhnliche Fähigkeit zur Phagozytose. Die Membran einer Makrophage ist flexibel und kann sich erheblich vergrößern, um auch große Partikel zu umschließen. Bei der Phagozytose „fließt“ die Membran um die zu verschlingenden Partikel herum. Obwohl die Klumpen durch Agglutination groß erscheinen können, sind Makrophagen durch ihre flexible Membran und effizienten Verdauungsmechanismen bestens dafür gerüstet, solche Agglutinat-Komplexe aufzunehmen und zu verdauen. Die Agglutination ist also ein Mechanismus, der die Effizienz der Immunantwort steigert, indem er die Erreger „zusammenpackt“ und so leichter für Makrophagen und andere Phagozyten zugänglich macht.
5.5.10. Regulatorische T-Zellen und ihre Rolle im Immunsystem
Regulatorische T-Zellen (Tregs) sind spezialisierte Immunzellen, die eine Schlüsselrolle bei der Aufrechterhaltung der Immuntoleranz spielen. Ihre Hauptaufgabe besteht darin, eine übermäßige oder fehlgeleitete Immunantwort zu verhindern, die zu Autoimmunerkrankungen oder Gewebeschäden führen könnte. Tregs unterdrücken die Aktivität von Effektor-T-Zellen (wie zytotoxischen T-Zellen und T-Helferzellen) und B-Zellen, die Antikörper produzieren.
Tregs üben ihre suppressive Funktion auf verschiedene Weisen aus:
Sekretion von Immunsuppressiven Zytokinen: Tregs produzieren Zytokine wie IL-10, TGF-β und IL-35, die entzündungshemmend wirken und die Aktivität von Effektor-T-Zellen und anderen Immunzellen dämpfen.
Modulation des Stoffwechsels: Tregs beeinflussen den Stoffwechsel anderer Immunzellen, indem sie den Zugang zu wichtigen Wachstumsfaktoren oder Energiequellen blockieren, was deren Aktivität einschränkt.
Direkter Zellkontakt: Tregs können über direkten Zell-Zell-Kontakt inhibitorische Signale an Effektor-T-Zellen übertragen, was deren Funktion blockiert.
Kontrolle der dendritischen Zellen (DCs): Tregs wirken auch auf antigenpräsentierende Zellen wie dendritische Zellen (DCs) ein, indem sie deren Fähigkeit zur Aktivierung von Effektor-T-Zellen herunterregulieren. Dies geschieht entweder durch Hemmung der kostimulatorischen Moleküle auf den DCs, die für die Aktivierung von Effektor-T-Zellen notwendig sind, oder durch Aufnahme von IL-2, einem wichtigen Wachstumsfaktor, den T-Zellen für ihre Vermehrung benötigen.
Induzierter Zelltod: In manchen Fällen können Tregs sogar den programmierten Zelltod (Apoptose) von überaktiven Immunzellen auslösen, um eine überschießende Immunantwort zu verhindern.
Tregs sind in der Lage, ihre Zahl und Aktivität dynamisch an die jeweiligen Erfordernisse des Immunsystems anzupassen. Während einer Infektion können sie zunächst weniger aktiv sein, um eine effektive Immunantwort zu ermöglichen. Nach dem Ende der Infektion werden sie jedoch aktiviert, um die Immunreaktion herunterzufahren und das Gewebe zu schützen.
Bedeutung bei Autoimmunität und Krebs
Eine Dysfunktion der Tregs kann zu Autoimmunerkrankungen führen, da das Immunsystem nicht mehr ausreichend reguliert wird und körpereigene Gewebe angreift. Allerdings können Tregs bei Krebs die Immunantwort abschwächen und dem Tumor dadurch helfen, der körpereigenen Abwehr zu entgehen.
Regulatorische T-Zellen sind also entscheidend für die Feinabstimmung und das Gleichgewicht des Immunsystems, indem sie nicht nur die Immunantwort gezielt abschwächen, sondern auch das Risiko von Autoimmunität verringern und die Toleranz gegenüber körpereigenen Geweben aufrechterhalten. Diese präzise Regulierung ist besonders wichtig in der Abschaltphase des Immunsystems, die nach einer erfolgreichen Immunantwort einsetzt.
5.5.11. Abschaltphase
Nach der Bekämpfung einer Infektion muss das Immunsystem sorgfältig heruntergefahren werden, um Schäden am Körper zu vermeiden. Wenn dieser Abschaltprozess nicht korrekt funktioniert, kann es zu Autoimmunerkrankungen oder chronischen Entzündungen kommen.
Die meisten Immunzellen, die während einer Infektion aktiviert werden, sterben nach ihrer Arbeit ab. Dies verhindert, dass der Körper durch eine Überzahl an Immunzellen geschädigt wird. Einige Zellen überleben jedoch und werden zu sogenannten Gedächtniszellen, die dem Körper helfen, zukünftige Infektionen schneller zu bekämpfen. Immunzellen können auf verschiedene Arten sterben, wie durch Apoptose (programmierter Zelltod) oder Nekroptose (eine Form von Zellzerfall). Diese Prozesse sind notwendig, um das Immunsystem nach einer Infektion zu beruhigen und wieder ins Gleichgewicht zu bringen.
Kontrolle der Immunantwort
Regulatorische T-Zellen: Nach Abschluss einer erfolgten Immunantwort produzieren die Regulatorischen T-Zellen Hemmstoffe, die die Plasmazellen und Killerzellen hemmen und die Immunreaktion stoppen.
Rolle von Antigenen: Antigene, also fremde Substanzen, die eine Immunantwort auslösen, verschwinden nach einer Infektion normalerweise aus dem Körper. Dies signalisiert den Immunzellen, dass ihre Arbeit abgeschlossen ist, und in Abwesenheit von Antigenen leiten viele dieser Zellen ihren eigenen Tod durch Apoptose ein.
Bleiben jedoch kleine Mengen von Antigenen im Körper zurück, kann dies verschiedene Auswirkungen haben. Einerseits kann es die Immunreaktion verlängern, was in manchen Fällen hilfreich ist, um sicherzustellen, dass die Infektion vollständig beseitigt wird. Andererseits kann es auch zu einem unnötigen Überleben und einer anhaltenden Aktivierung von Immunzellen führen, was das Risiko von chronischen Entzündungen oder Autoimmunreaktionen erhöhen könnte.
Es gibt auch Situationen, in denen das Vorhandensein von Restantigenen dazu beiträgt, eine gewisse Aktivität des Immunsystems aufrechtzuerhalten, was insbesondere bei chronischen Infektionen oder in der Tumorimmunologie von Bedeutung sein kann. Hier kann eine niedrige, kontinuierliche Stimulation durch Antigene das Immunsystem in einem „Wachsamkeitszustand“ halten, der vor einem erneuten Ausbruch der Krankheit schützt.
Insgesamt hängt die Auswirkung von verbleibenden Antigenen stark vom Kontext ab: Während es in manchen Fällen notwendig und nützlich sein kann, kann es in anderen Fällen zu unerwünschten immunologischen Reaktionen führen.
Bedeutung von Interleukin-2 (IL-2): IL-2 ist ein Botenstoff des Immunsystems, der das Überleben und die Vermehrung von T-Zellen fördert. Je nach Situation kann IL-2 jedoch auch zum Tod der T-Zellen führen, was zeigt, wie komplex und fein abgestimmt die Regulierung des Immunsystems ist.
Energiemanagement in Immunzellen: Aktivierte Immunzellen wechseln ihren Stoffwechsel, um sich an die Bedürfnisse während einer Infektion anzupassen. Sie nutzen zum Beispiel mehr Glukose, um Energie zu gewinnen. Am Ende der Immunreaktion müssen sie wieder in einen „Ruhemodus“ zurückkehren, um zu Gedächtniszellen zu werden.
5.5.12. Gedächtnisphase
Wie wir bereits erfahren haben, aktiviert die Immunantwort spezialisierte Zellen zur Bekämpfung des Erregers. In diesem Prozess werden nicht nur die akuten Abwehrmechanismen in Gang gesetzt, sondern es entstehen auch Gedächtniszellen. Diese Gedächtniszellen, bestehend aus langlebigen T- und B-Zellen, speichern spezifische Informationen über den Erreger und bilden das immunologische Gedächtnis. Dieses Gedächtnis ermöglicht es dem Immunsystem, sich an zuvor aufgetretene Krankheitserreger zu „erinnern“ und bei erneuter Exposition schneller und wirksam zu reagieren. Gedächtniszellen haben eine sehr lange Lebensdauer, im Gegensatz zu den Effektorzellen, die bereits während oder kurz nach der Infektion sterben. So trägt das immunologische Gedächtnis zur Entwicklung einer langanhaltenden spezifischen Immunität bei.
T-Gedächtniszellen
Während einer Infektion beginnt die Entwicklung von T-Gedächtniszellen bereits in den frühen Phasen der Immunantwort. Sobald eine naive T-Zelle ihr spezifisches Antigen über einen MHC-Komplex auf einer antigenpräsentierenden Zelle (APC) erkennt, wird sie aktiviert und beginnt sich rasch zu vermehren. Innerhalb weniger Tage kann eine einzige aktivierte T-Zelle auf Tausende bis Millionen von Klonen anwachsen – dieser Prozess wird als klonale Expansion bezeichnet. Während ein Teil dieser expandierten T-Zellen zu Effektor-T-Zellen wird, die unmittelbar an der Bekämpfung des Erregers beteiligt sind, differenziert sich ein anderer Teil zu T-Gedächtniszellen.
T-Gedächtniszellen zeichnen sich durch ihre lange Lebensdauer aus, oft über Jahrzehnte hinweg, und bewahren die spezifische genetische Information der ursprünglichen T-Zell-Rezeptor-Rekombination. Sie zirkulieren zwischen Blut und sekundären lymphatischen Organen wie Lymphknoten und Milz und sind stets auf der Suche nach einer erneuten Begegnung mit ihrem spezifischen Antigen.
Sollten T-Gedächtniszellen auf denselben Erreger treffen, erfolgt innerhalb weniger Stunden eine schnelle und effektive Immunantwort. Im Gegensatz zu naiven T-Zellen benötigen sie keine ständige Aktivierung durch körpereigene Moleküle und sind daher in der Lage, bei erneutem Kontakt zügig und effizient zu reagieren.
Darüber hinaus sind Gedächtnis-T-Zellen in der Regel zahlreicher als ihre naiven Vorgänger. Dies ermöglicht eine blitzschnelle Reaktion auf eine erneute Exposition gegenüber demselben Erreger, wodurch die Immunantwort so effektiv wird, dass oft keine Krankheitssymptome auftreten.
B-Gedächtniszellen
Nach ihrer Aktivierung durchlaufen B-Zellen, ähnlich wie T-Zellen, eine Phase intensiver Vermehrung. Die meisten dieser Zellen entwickeln sich zu Plasmazellen, die Antikörper produzieren, wie z.B. IgG im Blutkreislauf oder IgA an Schleimhäuten. Ein Teil der B-Zellen differenziert sich jedoch zu Gedächtnis-B-Zellen, die sich während der Affinitätsreifung und nach Abschluss der akuten Immunantwort bilden.
B-Gedächtniszellen zirkulieren durch den Blutkreislauf und die sekundären lymphatischen Organe, wie Lymphknoten und Milz, und sind auf der Suche nach ihrem spezifischen Antigen. In ihrem „ruhenden“ Zustand sind sie bereit, bei einer erneuten Begegnung mit dem Antigen schnell aktiviert zu werden.
Sobald B-Gedächtniszellen ihr Zielantigen erkennen, differenzieren sie sich rasch zu Plasmazellen, die entweder IgG-Antikörper im Blut oder IgA-Antikörper an Schleimhäuten produzieren, um das Pathogen zu neutralisieren. Diese Mobilität und kontinuierliche Überwachung von Blut, Schleimhäuten und lymphatischen Geweben sind entscheidend für ihre Rolle in der sekundären Immunantwort.
Anmerkung
Die genauen Mechanismen, die die Entstehung, das Überleben und die Kontrolle von Gedächtniszellen steuern, sind noch nicht vollständig verstanden.
[Beendigung der Immunreaktion]
Eine sehr schöne Zusammenfassung der adaptiven Immunantwort findet man in diesen Videos:
Cellular Immunity – Adaptive Immunity part 1
Humoral Immunity – Adaptive Immunity part 2
5.6. Zusammenfassung

Das Diagramm veranschaulicht die Phasen der Immunantwort während einer Infektion, beginnend mit dem Eindringen von Krankheitserregern bis hin zu ihrer Beseitigung. Es zeigt den zeitlichen Verlauf der Infektion (x-Achse) und die Anzahl der Krankheitserreger im Körper (y-Achse) in Bezug auf die Immunreaktion.
Etablierung einer Infektion: Dies ist die Anfangsphase der Infektion, unmittelbar nachdem die Krankheitserreger in den Körper eingedrungen sind. In dieser Phase beginnen sich die Krankheitserreger zu vermehren, und die körpereigenen angeborenen Abwehrmechanismen, wie Makrophagen und natürliche Killerzellen, versuchen, die Infektion einzudämmen. Wenn die Krankheitserreger erfolgreich die ersten Verteidigungslinien überwinden, etabliert sich die Infektion. In dieser Phase ist die Anzahl der Krankheitserreger noch relativ gering, kann jedoch schnell ansteigen.
Aktivierungsphase: Sobald die Anzahl der Krankheitserreger einen bestimmten Schwellenwert überschreitet, der durch die Antigenmenge bestimmt wird, setzt die adaptive Immunantwort ein. Diese Phase umfasst die Aktivierung von T-Zellen und B-Zellen, die spezifische Immunzellen sind, die das Pathogen gezielt erkennen und bekämpfen können. Diese Phase dauert mehrere Tage, da das Immunsystem die passenden Abwehrmechanismen entwickeln muss. Die Anzahl der Krankheitserreger kann weiterhin ansteigen, während die adaptive Immunantwort vorbereitet wird.
Effektorphase: In dieser Phase ist die adaptive Immunantwort vollständig aktiviert. T-Zellen und Antikörper greifen gezielt die Krankheitserreger an und zerstören sie. Die Anzahl der Krankheitserreger erreicht ihren Höhepunkt und nimmt dann rapide ab, da das Immunsystem die Kontrolle über die Infektion gewinnt. Dies ist die entscheidende Phase, in der das Pathogen schließlich beseitigt wird.
Gedächtnisphase: Nachdem das Pathogen beseitigt ist, tritt die Immunantwort in die Gedächtnisphase ein. In dieser Phase verbleiben Gedächtniszellen (spezifische T- und B-Zellen) im Körper, die auf eine erneute Infektion mit demselben Pathogen vorbereitet sind. Diese Zellen ermöglichen eine schnellere und effektivere Immunantwort, sollte der Organismus erneut mit dem gleichen Erreger konfrontiert werden. Die Krankheitserreger wurden eliminiert, und das Immunsystem hat ein „Gedächtnis“ für dieses spezifische Pathogen entwickelt.
Von der anfänglichen Etablierung der Infektion über die Aktivierung und Effektorphase der adaptiven Immunantwort bis hin zur langfristigen Gedächtnisbildung wird deutlich, wie das Immunsystem auf Krankheitserreger reagiert und sich an zukünftige Infektionen anpasst. Am Ende dieses Prozesses ist der Körper vorbereitet und in der Lage, schneller und effektiver auf das gleiche Pathogen zu reagieren.
Man ist immun.
6. Verborgene Verteidigung – die Macht der Kreuzimmunität
Wenn unser Körper mit einem Erreger in Kontakt kommt, setzt er eine erstaunlich komplexe Abwehrreaktion in Gang. Anstatt nur auf einen bestimmten Antikörpertyp zu setzen, bildet unser Immunsystem eine Vielzahl unterschiedlicher Antikörper, die verschiedene Teile des Erregers angreifen.
Ein fremdes Molekül (Antigen), dass das Immunsystem erkennt, besteht oft aus mehreren kleinen Abschnitten, den sogenannten Epitopen. Diese Epitope sind spezifische Bereiche auf der Oberfläche des Antigens, die von Antikörpern oder T-Zell-Rezeptoren erkannt werden. Jeder Epitop hat eine einzigartige Struktur, die von verschiedenen Antikörpern gebunden werden kann. Dabei konzentriert sich das Immunsystem oft auf die wichtigsten Bereiche des Erregers, wie zum Beispiel die Bindungsstellen an Wirtszellen, wie das Spike-Protein, oder andere funktionell wichtige Proteine, die für die Virusstruktur und -vermehrung wichtig sind, etwa Membranproteine.
Dadurch entstehen nicht nur Antikörper, die auf einen einzigen Teil des Virus abzielen, sondern eine ganze Bandbreite, die verschiedene Abschnitte des Virus angreift. Diese vielfältige Immunantwort hilft dabei, den Erreger auf verschiedenen Wegen zu bekämpfen und erhöht die Chancen, ihn unschädlich zu machen.

1) Dieses Bild zeigt eine schematische Darstellung eines Virus, an dessen Oberfläche Spike-Proteine herausragen. Diese Spike-Proteine, die für die Bindung an Wirtszellen benötigt werden, sind charakteristisch für einige Virusarten. Darüber hinaus sind kleinere Membran- und Hüllproteine in die Virushülle eingebettet, die zur Stabilität und Funktion des Virus beitragen. 2) Auf dem Spike-Protein sind verschiedene Epitope sichtbar – spezifische Bereiche, an die Antikörper binden können. Auch Membran- und Hüllproteine können als Zielstrukturen für Antikörper dienen. 3) Spezifische Antikörper binden sowohl an die Epitope des Spike-Proteins als auch an das Membran- und Hüllprotein. Durch die gezielte Bindung blockieren die Antikörper die Funktion des Virus und neutralisieren es.
In der Welt der Mikroben herrscht jedoch ein ständiger Wettlauf. Viren und Bakterien verändern sich, um dem Immunsystem zu entkommen. Sie ändern ihre Oberflächenstrukturen, damit sie als „neu” erkannt werden und eine frühere Immunantwort weniger effektiv ist.
Allerdings sind diese Veränderungen an den Oberflächenstrukturen oft geringfügig. Das bedeutet, dass sich nur bestimmte Teile des Erregers ändern, aber nicht alle. Wenn man früher beispielsweise mit einem Grippevirus infiziert war, ist es möglich, dass einige der gebildeten Antikörper auch an ein leicht verändertes Grippevirus binden können.
Hier kommt die Kreuzimmunität ins Spiel: Auch wenn das Virus mutiert ist, können einige Antikörper, die ursprünglich gegen den alten Erreger gerichtet waren, ähnliche Bereiche des neuen Erregers erkennen. Das bedeutet, dass das Immunsystem in der Lage ist, auch auf verwandte Viren zu reagieren, selbst wenn sie leicht verändert sind.

Links eine schematische Darstellung eines älteren Virus mit intakten Proteinen (Spike-, Hüll- und Membranprotein). Rechts das neue Virus, das veränderte Epitope im Spike- und Membranprotein aufweist, jedoch mit unverändertem Hüllprotein. In der Mitte sind die Antikörper abgebildet, die trotz der Veränderungen am neuen Virus weiterhin an bestimmte Epitope des Spike-Proteins sowie an das Hüllprotein binden können.
Kreuzimmunität ist ein faszinierendes Konzept, das zeigt, wie unser Immunsystem nicht nur gegen genau bekannte Erreger reagiert, sondern auch gegen verwandte Erreger, die ähnliche Eigenschaften besitzen. Sie bezeichnet die Fähigkeit des Körpers, durch eine frühere Infektion mit einem bestimmten Erreger auch teilweise gegen verwandte Erreger geschützt zu sein. Das kann bedeuten, dass eine Person bei einer erneuten Infektion mit einem ähnlichen Virus weniger schwer erkrankt oder sogar vollständig geschützt ist.
Meistens ist die Immunantwort bei Kreuzimmunität etwas schwächer, da die Antikörper nicht perfekt zu dem neuen Virus passen. Ihre Bindungsfähigkeit ist oft reduziert, was bedeutet, dass sie weniger effektiv sind, das neue Virus vollständig zu neutralisieren. Trotzdem kann diese abgeschwächte Reaktion dabei helfen, die Krankheit zu lindern oder den Erreger schneller unter Kontrolle zu bekommen.
Wenn das Immunsystem mit einer neuen Virusvariante konfrontiert wird, die sich stärker unterscheidet, beginnt es, neue und speziellere Antikörper zu produzieren. Die bereits vorhandenen Antikörper durch Kreuzimmunität können dem Körper jedoch einen kleinen Vorteil verschaffen, indem sie den Erreger zumindest teilweise bekämpfen, bis die gezieltere Abwehr aufgebaut ist.
Kreuzimmunität zeigt eindrucksvoll, wie flexibel und anpassungsfähig unser Immunsystem im ständigen Wettlauf gegen Krankheitserreger ist.
7. Wichtige Erkenntnisse zum Mitnehmen
Ein Meisterwerk der Natur: Unser Immunsystem ist das Ergebnis von Millionen Jahren Evolution. Es funktioniert wie eine hochentwickelte und mächtige Armee, die ständig bereit ist, uns zu schützen. Dabei passt es sich kontinuierlich an und entwickelt sich weiter, um neuen Bedrohungen effektiv begegnen zu können.
Fremd vs. Selbst: Das grundlegende Prinzip des Immunsystems besteht darin, zwischen körpereigenen und fremden Zellen zu unterscheiden.
Bereits bei der Geburt geschützt: Schon ab der Geburt besitzt der Mensch mindestens eine Immunzelle für jeden potenziellen Erreger auf diesem Planeten.
Die Rolle der Lymphknoten: Die adaptive Immunantwort erfordert, dass Krankheitserreger oder ihre Teile in die Lymphknoten gelangen (bzw. in die sekundären lymphatischen Organe), um die Produktion von Antikörpern zu starten.
Zwei Arten von Immunschutz: Es gibt das systemische Immunsystem, das über IgG-Antikörper den gesamten Körper schützt, und das mukosale Immunsystem, das die Schleimhäute mit IgA-Antikörpern verteidigt.
Kreuzimmunität: Kreuzimmunität beschreibt die Fähigkeit des Immunsystems, durch eine frühere Infektion mit einem ähnlichen Erreger auch gegen neue, verwandte Erreger geschützt zu sein. Dies kann einen zusätzlichen Schutzmechanismus bieten.
8. Schlusswort
Die hier vorgestellten Einblicke in unser Immunsystem bieten einen spannenden Überblick über die biologischen Prozesse, die unseren Körper vor Bedrohungen schützen und unser Überleben sichern. Auch wenn wir bereits viel über die Funktionsweise des Immunsystems wissen, bleibt vieles noch unentdeckt und unvollständig erforscht.
Ein interessantes Beispiel für die fortwährende Entwicklung unseres Wissens ist das Konzept der „trainierten Immunität“. Lange Zeit galt die angeborene Immunität als starr und unveränderlich – als eine unspezifische Abwehrlinie des Körpers, die in erster Linie auf akute Bedrohungen reagiert. Im Gegensatz zur adaptiven Immunität, die sich durch das Gedächtnis von T- und B-Zellen auszeichnet, schien die angeborene Immunität nicht in der Lage, sich anzupassen oder zu lernen. Doch neueste Forschungen haben gezeigt, dass auch die angeborene Immunität eine Art „Gedächtnis“ entwickeln kann. Bestimmte Zellen des angeborenen Immunsystems, wie Makrophagen und natürliche Killerzellen können durch frühere Begegnungen mit Pathogenen so modifiziert werden, dass sie bei späteren Infektionen schneller und effektiver reagieren können. Epigenetische Veränderungen ermöglichen es diesen Zellen, über längere Zeiträume hinweg im Gewebe präsent zu bleiben und die Immunabwehr zu unterstützen. [Angeborene Immunzellen sind lernfähiger als gedacht] Dieses neu entdeckte Potenzial erweitert unser Verständnis der angeborenen Immunität und zeigt, dass auch diese unspezifische Abwehr eine bemerkenswerte Fähigkeit zur Anpassung besitzt.
Auch wenn wir noch nicht alles entdeckt und verstanden haben, verstehen wir dennoch eines: Diese faszinierende und unsichtbare Welt in uns ist der Schlüssel zu unserer Gesundheit und unserem Wohlbefinden und verdient daher unsere fortwährende Aufmerksamkeit und Pflege.
Links für Interessierte
Immunologie-Lehrbuch in deutscher Sprache
Janeway Immunologie © 2018
Das Werk führt den Leser durch alle Aspekte des Immunsystems – vom ersten Einsatz der angeborenen Immunität bis zur Erzeugung der adaptiven Immunantwort.
Kapitel 1 – Grundbegriffe der Immunologie
Kapitel 2 – Die angeborene Immunität
Kapitel 3 – Die induzierten Reaktionen der angeborenen Immunität
Kapitel 4 – Antigenerkennung durch B-Zell- und T-Zell-Rezeptoren
Kapitel 5 – Die Entstehung von Antigenrezeptoren in Lymphocyten
Kapitel 6 – Wie Antigene den T-Lymphocyten präsentiert werden
Kapitel 7 – Signalgebung durch Rezeptoren des Immunsystems
Kapitel 8 – Die Entwicklung der B- und T-Lymphocyten
Kapitel 9 – Die T-Zell-vermittelte Immunität
Kapitel 10 – Die humorale Immunantwort
Kapitel 11 – Die Dynamik der angeborenen und adaptiven Immunantwort
Kapitel 12 – Das mucosale Immunsystem
Kapitel 13 – Das Versagen der Immunantwort
Kapitel 14 – Allergien und allergische Erkrankungen
Kapitel 15 – Autoimmunität und Transplantation
Anhänge
Die folgenden Links bieten eine ausgezeichnete Reihe von Erklärvideos zum Thema Immunsystem. Sie vermitteln anschaulich und verständlich die wichtigsten Aspekte und Funktionsweisen des Immunsystems.
Das Immunsystem erklärt
Diese Zellen machen dich immun gegen ALLES
Kleine Bomben im Blut – Das Komplement-System
Das Buch „Die Naturgeschichte des Immunsystems“ von Clemens Arvay [ISBN 978-3-86995-119-5] bietet eine umfassende und verständliche Darstellung der Funktionsweise des Immunsystems aus einer evolutionsbiologischen Perspektive. Arvay erklärt, wie das Immunsystem im Laufe der Evolution entstanden ist und welche Rolle es in der heutigen Zeit spielt. Das Buch ist sowohl für Laien als auch für Fachleute interessant, die mehr über die komplexen Zusammenhänge im Immunsystem erfahren möchten.
Quellen (Stand vom 04.10.2024)
